|
|
StarCareHome
本平台医疗信息及相关内容(含个案及研究结论)仅供参考,不构成诊疗、医学建议或疗效保证,相关结论可能存在争议。补剂/药品仅限成分分析(不涉品牌),用户自担使用相关内容、产品及外部链接风险;干预或用药前请咨询执业医师。
本帖最后由 StarCare 于 2025-7-19 22:38 编辑
ROSSIGNOL 医疗中心
利用循证医学优化您孩子的言语能力
Lanier Rossignol MD FAAFP
TACA 全国自闭症大会 | 2019年10月
lanierrossignol@gmail.com | 321.259.7111
免责声明
虽然 Lanier Rossignol 已尽力确保本演示文稿中的信息尽可能准确,但所提供的信息不附带任何明示或暗示的保证。本次讲座的目的是提供关于可能影响自闭症及其他病症患者的不同状况或治疗的信息。请注意,Lanier Rossignol 并非提供医疗建议,具体情况可能要求不同的治疗方法。本讲座中回顾的所有治疗方法均被视为超说明书使用且未经 FDA 批准。在开始任何治疗之前,请咨询您或您孩子的医生。
除利培酮(Risperidone)和阿立哌唑(Aripiprazole)用于治疗易激惹外,自闭症的所有治疗方法都是“超说明书”使用。
“为什么我的孩子在接受一年的言语和 ABA 治疗后还不说话,而我朋友的孩子却会了?”
什么是自闭症?


美国精神病学协会的《精神障碍诊断与统计手册》(DSM-5) 为诊断 ASD 提供了标准化标准。
- 社会沟通和社会互动方面持续存在的缺陷
- 受限的、重复的行为模式、兴趣或活动
DSM-5 的诊断标准基于观察且是主观的。
- 没有诊断自闭症的血液/生物学测试
- 自闭症是一种谱系障碍——有些儿童受影响轻微;而另一些则受影响严重。有些从出生就患有 ASD,而另一些则在不同的年龄出现倒退。
www.rossignolmedicalcenter.com | lanierrossignol@gmail.com
ASD 诊断很少能揭示 ASD 的潜在促成因素或病因
范式转变 -
- Soke 等人 (2018) 对 4-8 岁 ASD 儿童的研究发现:
- ● 95% 至少有一种共病/症状。
- ● ~50% 有 4 到 5 种共病。
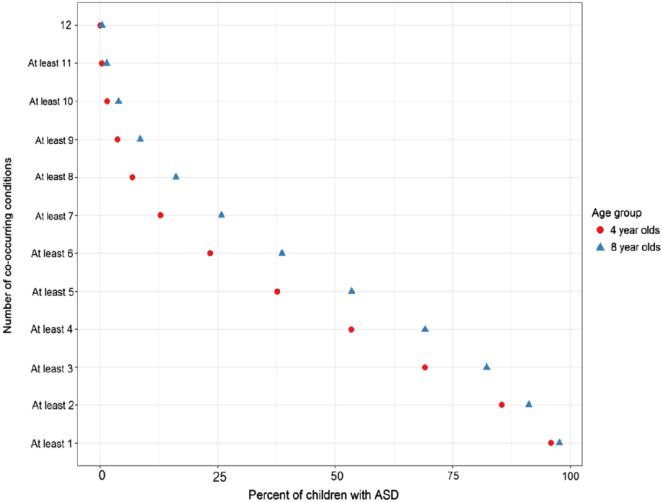
Soke, et al., 2018 J Autism Dev Disord 48(8):2663-2676
与自闭症相关的部分共病
胃肠道
- 喂养问题 5.1倍 (Mayes et al., 2019)
- 便秘 4.3-45.5% (Holingue et al 2018)
- 腹泻 2.3-75.6% (Holingue et al 2018)
- 炎症性肠病 0.18% (Lee et. al 2018)
- 低胆固醇 23% (Benachenhou, et al, 2019)
代谢
- 线粒体功能障碍 30-50% (Rossignol& Frye, 2012)
- 线粒体疾病 5% (Rossignol& Frye, 2012)
神经
- 癫痫 13-26% (Viscidi et al. 2013)
- ADHD 30-50% (Leitner, 2014)
- 书写障碍 59% (Mayes et al., 2019)
- 脑叶酸缺乏症 (Fry& Rossignol, 2012)
内分泌
过敏
- 食物过敏 11.3% (Xu et al., 2018)
- 环境过敏 18.7% (Xu et al., 2018)
- 皮肤过敏 16.8% (Xu et al., 2018)
精神障碍
- 焦虑 60-80% (Wijnhoven et. Al. 2018)
- 恐惧症 29.8% (van Steenel et al., 2011)
- 强迫症 (OCD) 17.40% (van Steensel et al, 2011)
- 网络成瘾 10.80% So et al., 2017)
- 抑郁 48.6% (Hudson et al., 2019)
- 自杀意念/企图 (Mayes, 2013)
- 双相情感障碍 6-21.4% (Selten et. Al 2015)
- 紧张症 12-17% (Mazzone et.Al 2014)
- 攻击性 49-68% Kane& Mazurek, 2011)
- 据报道,几种代谢异常可能导致或引起潜在可逆的自闭症形式
- *例如,脑叶酸缺乏症 (Cerebral Folate Deficiency)
- 目标是快速筛查这些异常,识别它们,并开始治疗
- 可通过测量某些生物标志物(可能识别异常的实验室检测)来完成测试
ASD 具有明确的生物学基础,具有已知医学障碍的特征(例如,在我看来,它不仅仅是一种精神障碍)。
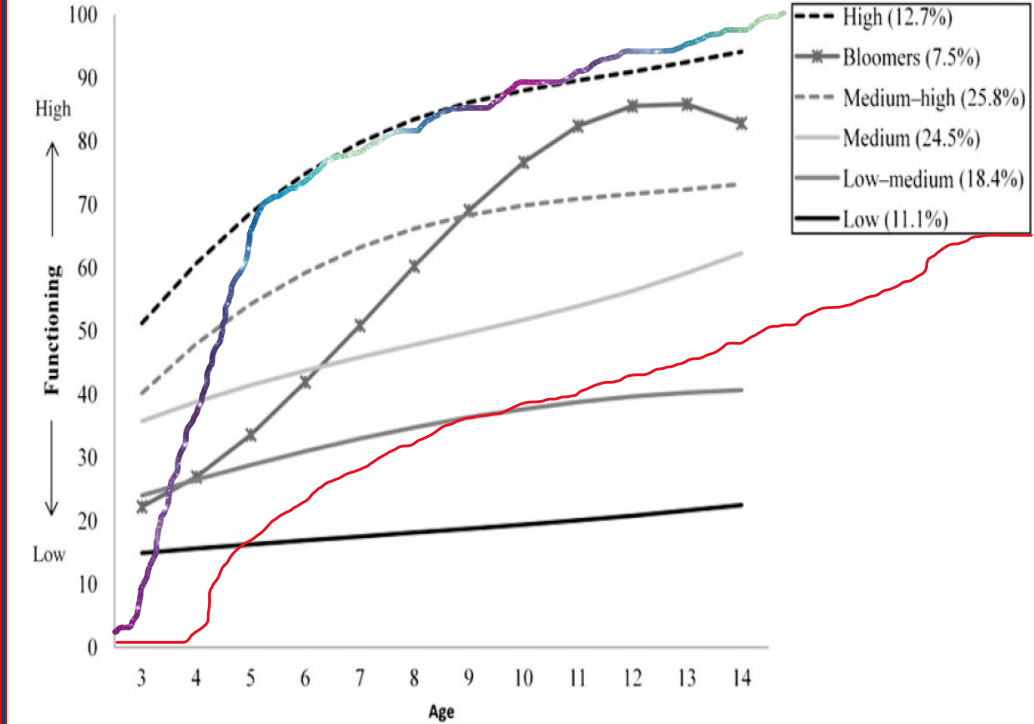
六种发育轨迹描述了自闭症儿童的特征
Fountain, et al., 2012 Pediatrics 129(5):e1112-1120
ASD 中言语迟缓的常见可能原因
基于研究/临床实践
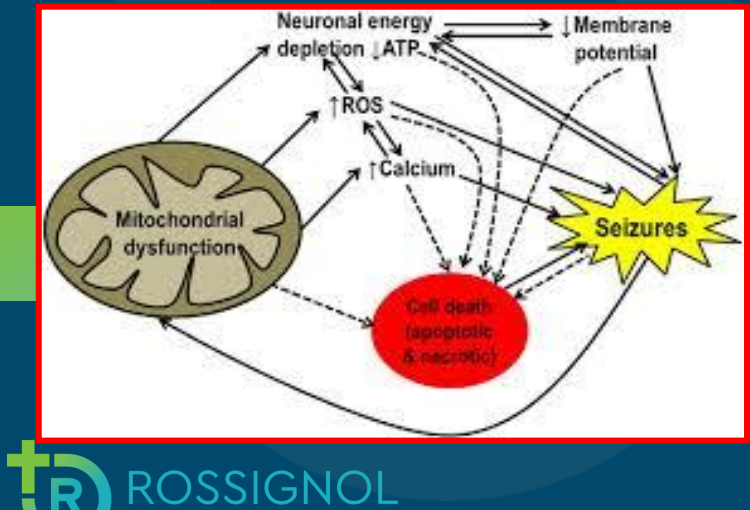
证据链接了自闭症患者大脑中的氧化应激、线粒体功能障碍和炎症
一项系统综述
ASD 的特征是氧化应激、线粒体功能障碍和免疫失调/炎症。
在 ASD 患者脑组织的尸检研究中发现了氧化应激、线粒体功能障碍和炎症的证据。
有趣的是,在 ASD 个体中发现存在这些生理异常的大脑区域涉及言语和听觉处理、社会行为、记忆以及感觉和运动协调。
这些发现表明 ASD 具有明确的生物学基础,具有已知医学障碍的特征。
Rossignol and Frye, 2014 Front Physiol 5:150
线粒体疾病/功能障碍作为 ASD 言语迟缓的可能原因
- 线粒体是我们身体每个细胞中的发电厂(“电池”)。线粒体以三磷酸腺苷 (ATP) 的形式为我们的心脏、大脑、肌肉、消化系统等提供能量。
- 我们的线粒体利用我们吃的食物和呼吸的空气产生能量 (ATP),使我们能够跑/走、集中注意力/注意、读/写/学习、说话。
- 患病/功能障碍的线粒体会导致个体出现多系统问题。
线粒体功能障碍与 ASD
- 线粒体功能障碍是与 ASD 相关的最常见代谢异常 (Rossignol& Frye, 2011)。
- 生物标志物数据表明,约 1/3 的 ASD 儿童存在线粒体功能障碍。
- 一项小型对照研究表明,ASD 中线粒体功能障碍(至少在淋巴细胞中测量)的患病率可能高达 80% (Giulivi et al., 2010)
- Giulivi C, Zhang YF, Omanska-Klusek A, Ross-Inta C, Wong S, Hertz-Picciotto I, Tassone F, Pessah IN 2010 Mitochondrial dysfunction in autism. JAMA 304:2389-2396
- Rossignol DA, Frye RE 2011 Mitochondrial dysfunction in autism spectrum disorders: a systematic review and meta-analysis. Mol Psychiatry, Mol
ASD 中的获得性线粒体疾病
- 许多患有自闭症和线粒体疾病 (MD) 的个体没有特定的基因突变来解释 MD,这引发了一种可能性,即 MD 可能是在 ASD 儿童的一个亚组中获得的。
自闭症中线粒体功能障碍的潜在原因(继发性)
- 谷胱甘肽浓度降低
- 自由基 (ROS) 增加
- 肿瘤坏死因子 (TNFα) 增加
- 一氧化氮 (NO) 增加
- 谷氨酸
- 环境毒物
- 钙信号异常
- 丙酸/梭菌
- 脑叶酸缺乏症
- 药物:例如,利培酮抑制复合物 I
自闭症儿童大脑区域特异性线粒体电子传递链复合物
- 在以下区域发现线粒体复合物活性显著降低:
- ● 小脑 - 复合物 III & V
- ● 额叶皮层 - 复合物 I
- ● 颞叶皮层 - 复合物 II, III & V
线粒体疾病/功能障碍
- 可出现在任何年龄
- 考虑家族史
- 不存在可靠的生物标志物
- 诊断不足
- 当 3 个或更多器官系统受累且无法用单一诊断解释时,应考虑 MD
- 有些儿童有线粒体功能障碍 (MtD),但未达到 MD 的程度
- 由于其多样的症状和临床表现,线粒体疾病在临床上可能难以识别
线粒体疾病的症状
- “任何器官的任何症状在任何年龄”
- 发育或生长迟缓
- 运动发育迟缓
- 笨拙
- 发育倒退
- 癫痫发作
- 肌张力低下(肌肉张力低)
- 偏头痛
- 胃肠道异常(腹泻、便秘)
- 认知处理速度慢
- 疲劳/嗜睡
- 平衡或协调受损
- 心肌病
- 肌病(肌肉疾病)
- 氧化应激
Rossignol and Frye, 2011 Mol Psychiatry, doi:10.1038/mp.2010.136
MITO SWAB 报告:如何解读
MITOswab 测试:在患者的口腔细胞中测量线粒体呼吸链复合物 (RC-I 和 RC-IV) 活性和柠檬酸合酶 (CS) 酶活性,以评估口腔细胞样本中的线粒体功能。
结果值 -(观察值)
| 活性名称 | 值* | ^正常范围^(平均值±标准差) | | 口腔细胞总蛋白产量(微克) | 546 | | | 柠檬酸合酶§ | 19.9 (164%) | 4.4-22 (12.1±5.1) | | RC-IV (RC-IV/CS) | 0.167 (54%) | 0.15--0.6 (0.31±0.1) | | RC-I (RC-I/CS) | 2.1 (30%) | 3.4--11.9 (6.8±2.0) |
- 复合物 IV 为 54%(满分 100%)
- 复合物 I 为 30%(满分 100%)欠佳
- 该患者的柠檬酸合酶为正常值的 164%。 这意味着该患者产生的线粒体比平均水平多 64%,以补偿复合物 I 的功能低下。
- 当细胞达到制造更多线粒体的最大能力时,面临疾病或毒素暴露等线粒体压力源,个体可能会崩溃或技能倒退。
一些 ASD 儿童没有制造更多线粒体的能力。
临床案例 - Caleb(化名)
- 4 岁,患有 ASD 症状:
- ● 言语迟缓
- ● 非常易激惹
- ● 没有玩耍/与他人互动的动力
- ● 喜欢只坐在一个地方。
- ● 如果需要走路或跳跃就会哭。
- ● 生长发育不良
- ● 长期便秘
- 显著实验室检查结果:MTHFR C677T 杂合子,维生素 D 低为 28(参考范围 30-100),3 种酰基肉碱升高
- 正常的线粒体实验室检查 - CK,丙氨酸与赖氨酸比值 1.3 (<2.5),肉碱谱
图2 Morava 等人, 2006 线粒体疾病诊断标准
| 案例 CALEB Morava 标准 | | | 运动不耐受 | 1 | | 肌无力 | 2 | | 发育迟缓 | 3 | | 生长发育不良 | 4 | | 便秘(胃肠道问题) | 5 | | 丙氨酸正常 | 0 | | 乳酸正常 | 0 | | 总分 | 5 可能为线粒体疾病 |
第一部分:临床体征和症状(按指示每个体征/症状 1-2 分。本部分最高 4 分)
案例 CALEB - Mito Swab
MITOswab 测试:在患者的口腔细胞中测量线粒体呼吸链复合物 (RC-I 和 RC-IV) 活性和柠檬酸合酶 (CS) 酶活性,以评估口腔细胞样本中的线粒体功能。
结果值 -(观察值)
| 活性名称 | 值* | ^对照组平均值 ± 标准差 | ^对照组范围(平均值) | | 口腔细胞总蛋白产量(微克) | 400 | | | | 柠檬酸合酶 | 7.85 (65%) | 12.1±5.1 | 4.4-22 | | RC-IV (RC-IV/CS) | 0.145 (47%) | 0.31±0.1 | 0.15-0.6 | | RC-I (RC-I/CS) | 1.53 (23%) | 6.8±2.0 | 3.4±11.9 |
- 复合物 I 为 23%(满分 100)
- 复合物 IV 为 47%(满分 100)
- 柠檬酸合酶为 65%(满分 100)
- Caleb 没有制造额外的线粒体来抵消低功能的复合物 I 和轻度低下的复合物 IV
添加 MB12 - 妈妈报告“它唤醒了他,他开始与家人互动”。添加亚叶酸和左旋肉碱后,CB 开始:
CB 对基础线粒体治疗的反应
- 说话更多,能口头提出要求 - 告诉妈妈,“我需要我的补充剂。”
- 现在和其他孩子一起玩,并要求一起玩。
- 骑自行车行驶了 1/4 英里。以前如果要求走几步或跳就会哭。
- 和兄弟姐妹一起骑滑板车
- 玩 Wii 跳舞游戏时和兄弟姐妹一起跳舞
- 不那么刻板/强迫/过渡更好
- 每天吃 2000 卡路里,体重增加,现在生长曲线为 5%
ASD 中线粒体功能障碍的治疗方法
- 线粒体疾病的常用治疗方法已被发现可以改善研究中的核心和相关 ASD 症状。
- (Frye and Rossignol, 2014 Front Pediatrics 2:66)
- 双盲、安慰剂对照 (DBPC) 研究已调查:
- ● L-肉碱
- ● 含 B 族维生素的复合维生素
- ● 抗氧化剂
- ● 维生素 E,
- ● 辅酶 Q10
- ● 泛醇(非盲法研究)
- ● 亚叶酸(叶酸钙) -(对照和非对照研究)
肉碱:与安慰剂相比,可改善 ADHD 的注意力和自闭症的言语能力
- 肉碱帮助将长链脂肪酸转运到线粒体中产生能量
- 肉碱是一种抗氧化剂,可中和自由基,包括线粒体在产生 ATP 过程中产生的那些
- 高剂量补充可能导致腹泻和多动
治疗方法:MD
- 辅酶 Q10:5-10 mg/kg/天
- 乙酰-L-肉碱:50-100 mg/kg/天
- L-肉碱 (Carnitor)
- 硫胺素 (B1):15 mg/kg/天
- 吡哆醇 (B6):5-15 mg/kg/天
- 核黄素 (B2):15 mg/kg/天
- 泛酸 (B5):15 mg/kg/天
- 维生素 E:15 IU/kg/天
- 维生素 C:25 mg/kg/天
- 硫辛酸:15 mg/kg/天
- 维生素 K:5-80 mg/天
- 亚叶酸:1-10 mg/天
- 一水肌酸:5-10 g/天
- B12、硒、琥珀酸、银杏叶
- D-核糖:0.5-1 克 bid(每天两次)
- 高压氧治疗 (HBOT)
为什么麻醉可能对我们任何人都不好,尤其是线粒体疾病患者
阅读更多:WWW.BABYFOODSTEPS.COM
HBOT 和线粒体功能障碍
- HBOT 降低脑乳酸并改善创伤性脑损伤 (TBI) 中的线粒体代谢
- HBOT 可能导致线粒体生物合成
- 从较低压力开始(1.3 至 1.5 大气压)
- 与知识渊博的医生合作
- 线粒体在中央神经系统中起着特别重要的作用。
- 大脑消耗我们每日卡路里摄入量的约 20% (Raichle and Gusnard, 2002)。
- 大脑使用大量 ATP 来维持对神经传递和可塑性至关重要的离子梯度 (Harris et al., 2012)
- 治疗线粒体功能障碍可能使某些个体的 EEG 正常化。
癫痫作为 ASD 个体言语迟缓的可能原因
人脑由约 1000 亿个神经元组成
神经元(神经细胞)通过电脉冲相互交流,这些电脉冲通过钠、钾和氯离子通道的打开和关闭产生的膜电位快速变化来传递信息。
癫痫发作发生在$$\text{大脑中出现过度神经元放电时。异常电}$$$$\text{活动发生的大脑位置影响患者的表现。}$$
癫痫发作的症状
- 患者可能经历奇怪的感觉和情绪,或表现出奇怪的行为,或有肌肉痉挛、抽搐和/或失去意识。
- 亚临床(沉默性)
- 凝视发作(愣神)
- 快速眨眼、用手捂住耳朵、无端哭闹发作
- 意识丧失
- 剧烈抽搐
- 先兆:奇怪的感觉(如刺痛感、情绪变化或闻到不存在的异味)
- 部分性发作:
- 全面性发作:
- ● 失神发作
- ● 强直-阵挛发作
- ● 肌阵挛发作
- ● 失张力发作
- 无法说话
单纯部分性发作:局灶性 - 大脑小区域
意识未受损
症状
- 不寻常的头部动作
- 目光呆滞/眼睛左右移动
- 麻木/刺痛感,皮肤爬行感(像虫子在你皮肤上爬)
- 幻觉(看到、闻到或听到不存在的东西)
- 疼痛/不适、恶心、
- 面部潮红/出汗
- 瞳孔放大/视觉变化
- 似曾相识感
- 情绪/情感变化
复杂部分性发作
- 可能包括行为停止、凝视太空、口部自动症(咀嚼或吞咽);肢体自动症(手部无功能动作)和记忆丧失
- 对发作前后发生的事情有记忆丧失
- 会极大影响学业表现
- 复杂部分性发作可演变为全面性发作。
全面性发作 - 类型
- 全面性强直-阵挛发作 - 抽搐,肌肉强直伴意识丧失
- 失张力发作 - 肌肉张力突然丧失(头下垂、姿势丧失或突然跌倒)。
- 肌阵挛发作 - 身体肌肉快速而短暂的收缩,通常发生在身体两侧同时。
- 失神发作 - 短暂意识丧失,“凝视发作”也可能包括口部或肢体自动症;无发作后状态。
失神发作 - 全面性发作
- 短暂的无反应凝视,可能每天 50-100 次发作。
- 也可能包括口部自动症(从呻吟等简单发声到复杂的、可理解的刻板言语)或肢体自动症。
- 颞叶癫痫中最常见的自动症是口部(例如,咂嘴、咀嚼、吞咽)和手动(例如,挑拣、摸索、轻拍)。
- 无发作后状态
- 需要快速有效的治疗,因为它们会干扰学习
年轻自闭症患者的癫痫:一项基于人群的 120 名儿童期诊断患者的随访研究
- 120 名 ASD 研究参与者中有 38% 患有癫痫。
- 在患有 ASD 和癫痫的研究参与者中;1/3 在 2 岁前就出现癫痫发作。
Danielsson S1, Gillberg IC, Billstedt E, Gillberg C, Olssonl. Epilepsy in young adults with autism: a prospective population-based follow-up study of 120 individuals diagnosed in childhood Epilepsia. 2005 Jun;46(6):918-23
癫痫发病率
- 普通人群 1-2%
- 患病率范围为 8-42%,大多数估计为 25-30%
- EEG 癫痫样活动的患病率接近 60%
- 高达 2/3 的自闭症个体 EEG 异常
- 1/3 EEG 正常
- 1/3 患有癫痫
- 1/3 有亚临床放电
ASD 中的癫痫发作
- 两个年龄高峰:大约 4-6 岁和 10 岁以后
- 男孩和女孩机会均等
- 10 岁以上的儿童患癫痫的可能性是 2.4 倍 [Viscidi, 2013b]
- 患有癫痫的 ASD 儿童通常更易怒和多动 [Viscidi 2013a]
- 个子高的自闭症儿童更可能患有癫痫
癫痫检查 (Seizure Work Up)
- 体格检查
- 神经系统检查:寻找神经功能缺损。
- 如果怀疑脑损伤或肿瘤:MRI 或 CT
- 实验室检测:CMP(综合代谢面板)、CBC(全血细胞计数)、LFTs(肝功能测试)、肾功能测试、腰椎穿刺、药物筛查
- EEG 或 MEG(脑磁图)
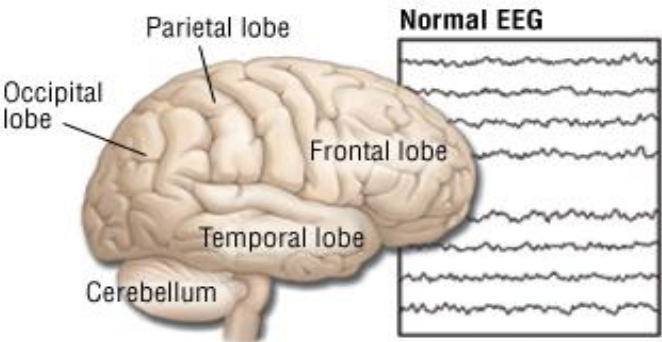
脑电图 (Electroencephalography - EEG)
- 脑电图 (EEG) 是一种使用附着在头皮上的小电极检测大脑电活动的测试。
- 即使在你睡觉时,你的脑细胞也会通过电脉冲进行交流。这种活动在 EEG 记录上显示为波浪线。
EEG 的局限性 (Pitfalls of EEGs)
- 常规 EEG 是 45 分钟的测试,经常漏诊癫痫,尤其是睡眠中发生的癫痫 (Sarkis, Loddenkemper, Burgess, Wyllie, 2009)。
- 即使是 36 小时 EEG 也可能漏诊癫痫活动
- 即使某人每周都有癫痫发作,其 EEG 测试也可能是正常的。
- EEG 仅显示测试期间的大脑活动。
- SPECT 扫描是一种核医学成像扫描,结合了计算机断层扫描 (CT) 和放射性示踪剂。它主要用于观察大脑中的血流情况。
- 当大脑某个区域的血流增加时,该区域在扫描中会变得更亮。在癫痫发作期间,更多的血液流向癫痫起源的区域,这使得该测试对于定位癫痫起始区非常有价值。
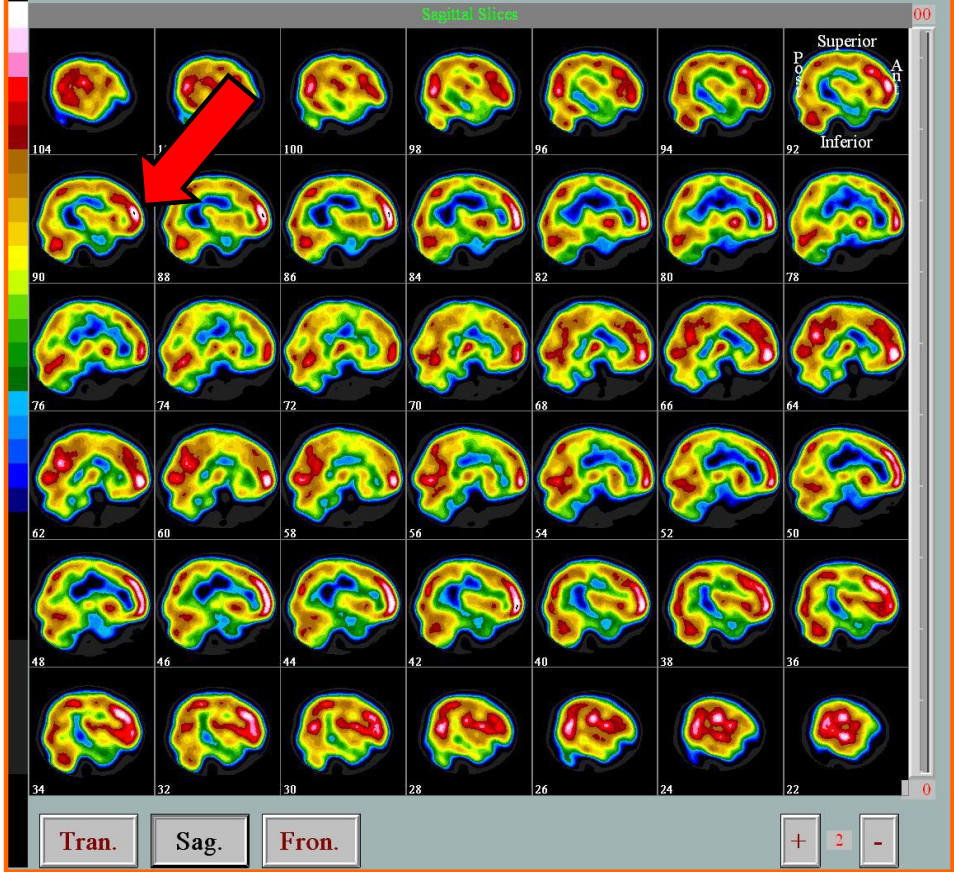
癫痫的治疗 (Seizure: Treatments)
- 营养补充剂
- 药物
- 类固醇/静脉注射免疫球蛋白 (IVIG)
- 饮食(生酮饮食)或改良阿特金斯饮食 (Modified Atkin's Diet)
- 高压氧治疗 (HBOT)
- 迷走神经刺激器
- 手术
ASD 中癫痫的传统和新型治疗——系统综述
在 ASD 中发现最有效的癫痫药物:丙戊酸 (Valproate)、拉莫三嗪 (Lamotrigine) 和左乙拉西坦 (Levetiracetam)
一些支持替代治疗的证据:
生酮饮食、改良阿特金斯饮食、免疫调节疗法和神经反馈疗法
Frye, Rossignol et al., 2013 Front Public Health 1:31
具有抗癫痫活性的补充剂
- 褪黑素 (Melatonin)
- 牛磺酸 (Taurine)
- 维生素 B6/ P5P
- 镁 (Magnesium)
- Omega-3 脂肪酸
- GABA
- DMG (二甲甘氨酸)
- L-肌肽 (L-Carnosine)
- 亚叶酸 (Folinic acid)
非典型认知发育中的脑电图放电
对 22 名脑电图放电异常且发育性认知障碍、标准教育干预无效的患者进行的病例系列研究- 91% 的研究参与者患有言语或语言障碍。
- 绝大多数患者 (70%) 在尝试抗癫痫药物治疗后反应良好。
- 另外 10% 的患者仅在增加抗癫痫药物剂量后才有反应。
| 对 AED(抗癫痫药物)治疗的临床反应 | | | 所有患者, % | 延迟治疗的患者, % | | 1 次门诊就诊内明确改善 | 70 | 72 | | 增加 AED 剂量后明确改善 | 10 | 9 | | 可能改善 | 5 | 9 | | 无改善 | 15 | 9 |
(Frye et al. 2010)
高压氧治疗在癫痫治疗中的应用研究
第11届国际高压氧医学会议论文集- 100 名癫痫患儿接受 1.7-2.0 ATM 100% 氧气高压氧治疗 (HBOT),每天 80 分钟,共 15-45 次。
- HBOT 对 82% 的患者有效
- 对 68% 的患者效果显著
- 43 名患者能够停用癫痫药物,其他患者能够减少癫痫药物剂量。
脑叶酸缺乏症 (Cerebral Folate Deficiency - CFD):与 ASD 言语迟缓相关
大纲
- 叶酸及叶酸类型
- 叶酸运输
- 定义脑叶酸缺乏症 (CFD)
- CFD 的原因
- CFD 的临床特征
- 自闭症中 CFD 和叶酸受体 (FR) 自身抗体的患病率
- 牛奶与 FR 自身抗体
- 检测
- 治疗
- 预防
叶酸(维生素 B9)(Folic Acid (Vitamin B9))
- 叶酸 (Folic acid) – 用于维生素补充剂和强化食品的叶酸形式
- 水溶性
- 叶酸的合成形式
- 叶酸的无活性形式
- 在 FR1 受体处抑制 5-MTHF(活性叶酸),并可能加重 CFD 症状
- 存在超过 100 种叶酸类似物
- 叶酸 (Folate) = 天然存在于食物中
MTHFR (亚甲基四氢叶酸还原酶)
- MTHFR (亚甲基四氢叶酸还原酶) 是将无活性的叶酸转化为 5MTHF(一种活性叶酸形式)的最后一步。
- MTHFR 突变在一般人群中很常见,且在 ASD 中更高。
- MTHFR C677T
- MTHFR A1298C
- MTHFR 上的突变/SNP 可导致可用于关键生物通路的 5MTHF 减少。
补充剂中可用的活性叶酸示例(亚叶酸)(Folinic)
- 亚叶酸 (Folinic acid, 5-甲酰四氢叶酸):
- 通过还原型叶酸载体 (Reduced Folate Carrier - RFC) 穿过血脑屏障
- 生物活性 - 不需要经过 MTHFR 途径
- 在叶酸通路中用途广泛:
- DNA/RNA 和神经递质合成
- DNA 甲基化(开关)
- 解毒途径
- 产生 5-MTHF(用于钴胺素甲基化为 MB12 和蛋氨酸合酶)
- 避免叶酸陷阱 (folate trap)
- 用于治疗 CFD 的研究中
补充剂和处方药(Deplin)中可用的活性叶酸示例(甲基叶酸)(5MTHF)
- 5MTHF (5-甲基四氢叶酸)
- 通过叶酸受体 1 (FR1) 穿过血脑屏障,该受体可能被维生素中的无活性叶酸或 FR1 自身抗体阻断
- 它使钴胺素(维生素 B12)甲基化以产生甲基钴胺素 (MB12),供蛋氨酸合酶 (MS) 使用
- 如果无法被利用,它可能产生或加重现有的叶酸过量(“叶酸陷阱”)
为什么活性叶酸对脑功能至关重要?
活性叶酸对以下方面至关重要:
- 同型半胱氨酸代谢
- 解毒
- DNA 甲基化(开关)
- 神经递质合成
- 核酸生物合成
- 胎儿和新生儿大脑发育
叶酸运输 (Folate Transportation)
- 还原型叶酸载体 (Reduced Folate Carrier - RFC)
- 叶酸受体 α (Folate Receptor alpha - FRα)
血脑屏障 (Blood Brain Barrier - B.B.B.)
- 循环血液和脑脊液之间的物理屏障
- 细胞运输机制系统
- 维持稳态
- 限制血液中有害化学物质的进入,并允许必需营养物质的进入
还原型叶酸载体 (RFC)
可能影响治疗的因素:
- 存在于每个细胞的膜上,调节还原型(活性)叶酸进入细胞的递送
- RFC 的多态性与杂合突变自闭症风险增加 2.26 倍或纯合突变风险增加 1.96 倍相关
- 具有 RFC 杂合突变和 MTHFR C677T 突变的儿童,其杂合 C677T 突变的自闭症风险增加 3.24 倍,纯合 C677T 突变的风险增加 4.4 倍
- 具有 RFC 纯合突变和 C677T 杂合突变的儿童自闭症风险增加 3 倍
James, et al., 2006 Am J Med Genet B Neuropsychiatr Genet 141B(8):947-956
James, et al., 2006 Am J Med Genet B Neuropsychiatr Genet 141B(8):947-956
叶酸受体 1 (FR1)
- FR 1 受体存在于大脑血脑屏障的脉络丛区域。
- 由 FOLR1 基因编码。
叶酸转运入脑
- 活性叶酸 (5MTHF) 要进入大脑,必须通过与血脑屏障 (BBB) 中的叶酸受体 1 (FR1) 结合来运输。
- 然后通过还原型叶酸载体 (RFC) 转运到脑脊液 (CSF) 和神经元中。
- 在此过程中,FR1 的叶酸转运是 ATP 依赖性的(需要能量 - 因此如果线粒体功能障碍可能会受损)。
脑叶酸缺乏症 (CFD) - 一种神经代谢综合征
CFD 与以下相关:
- 大脑中 5MTHF(活性叶酸)水平低,而血液中 5MTHF 水平正常。
- 脑叶酸缺乏症 (CFD) 是少数可治疗且可能可逆的进行性神经系统疾病之一。
- 多项研究报告了 CFD 与 Rett 综合征以及某些自闭症儿童的关联。
CFD 的原因包括
- 自身免疫性(针对叶酸受体的自身抗体)
- 线粒体疾病 - 因为将活性叶酸运输到大脑需要 ATP(能量)。
- FOLR1 基因的罕见突变
- 严重的 MTHFR 缺陷
叶酸受体 1 (FR1) 自身抗体
- 与脑叶酸缺乏症 (CFD) 综合征、低功能自闭症和 Rett 综合征相关
- FR 自身抗体阻断 FR1 上的叶酸结合位点,损害叶酸向中枢神经系统的转运
- 如果不治疗,自身抗体的浓度会随时间增加
Ramaekers et al., 2007 Neuropediatrics 38(6):276-81
自闭症儿童脑脊液叶酸缺乏的研究- 25 名患有早发性低功能自闭症伴或不伴神经功能缺损的患者。
- 评估了血液叶酸水平和 FR1 阻断自身抗体,
- 并进行了腰椎穿刺以测量脑脊液 (CSF) 中的 5MTHF 水平。
- 血液叶酸水平在正常范围内
- 23/25 名患者的脑脊液中 5MTHF 水平低。
- 19/23 名患者叶酸受体抗体阳性,这解释了大多数患者 CSF 5MTHF 低的原因
- 口服亚叶酸补充剂 12 个月后,导致 CSF 5MTHF 正常化,并出现部分或完全临床康复。
线粒体功能障碍与 CFD
- 在线粒体功能障碍中,脉络丛上皮细胞可能无法产生足够的 ATP 来主动将 5MTHF 转运至 CSF
- 有趣的是,亚叶酸被一些医生用于“线粒体鸡尾酒疗法”
Ramaekers et al., 2007 Neuropediatrics 38(4):184-7
线粒体疾病病例报告- 叶酸向大脑的转运依赖于 ATP 驱动的、由叶酸受体介导的、穿过脉络丛上皮细胞的转运。
- 这是一例 Kearns-Sayre 综合征伴线粒体复合物 I 脑肌病患者的病例报告,该患者 CSF 中 5-MTHF 水平也低。
- 血清叶酸受体自身抗体阴性,无法解释脑脊液叶酸水平低。
- 加用亚叶酸治疗 3 年,导致部分临床改善,包括癫痫完全控制,随后脑干、丘脑、基底节和白质的脱髓鞘显著恢复。
- 该病例中 ATP 产生失败为在这种疾病中发现脑脊液 (CSF) 5-MTHF 水平低提供了一种可能的解释。
CFD 的临床特征
自身免疫性脑叶酸缺乏症
- 典型的自身免疫性脑叶酸缺乏症的特征是早期发育正常,随后出现急剧的神经功能退化。在大约 4 个月时,受影响的儿童表现出明显的易激惹、头围增长减速、精神运动发育迟缓、共济失调、痉挛、运动障碍(舞蹈手足徐动症和投掷症)、视力丧失、听力丧失和肌阵挛性癫痫。
Zsila Sadighi, Ian J. Butler, Mary Kay Koenig, MD (2012). Adult-Onset Cerebral Folate Deficiency. Arch Neurol. 2012;69(6):778-779.
临床特征:CFD
- 少数儿童在第一年发育正常,随后出现痉挛和共济失调;认知功能轻度受损或正常(晚发型痉挛性共济失调 CFD)
- 20% 的 CFD 儿童出现自闭症特征;CFD 是一些自闭症儿童倒退的已知原因
- 许多 CFD 儿童有言语迟缓
- 有些会出现听力或视力丧失
- 1/3 的儿童会出现癫痫发作;癫痫发作可能变得难治
- 许多儿童发展为中度至重度智力残疾
- CFD 存在一个谱系
自闭症中 CFD 和 FR 自身抗体的患病率
叶酸受体自身抗体的患病率
- 似乎未被充分认识
- 阻断性抗体 (Blocking antibody)
- 美国:估计 10-15%(低滴度)
- 西班牙:7%
- 爱尔兰:13%
- 结合性抗体 (Binding antibody)
- 美国:15-17%
- 爱尔兰:32%
- 无神经系统障碍儿童中自身抗体的发生率约为 2-3%,在普通人群中随着年龄增长而趋于增加,65 岁后达到 10-15%。
自闭症谱系障碍儿童血清叶酸受体自身抗体高患病率:一项对照研究- 对 40 名 ASD 儿童和 42 名正常发育 (TD) 儿童血液样本中叶酸受体抗体频率的研究。
- 血清 FRAA(叶酸受体抗体)存在于:
- 77.5% (31/40) 的 ASD 儿童中
- 54.8% (23/42) 的 TD 儿童中 (P = 0.03746, Fisher's 精确检验)。
- ASD 儿童中血清 FRAA 比 TD 儿童更普遍。
Zhou, et al., 2018 Biomarkers:1-9
叶酸受体自身抗体在诊断为自闭症谱系障碍的儿童、其正常兄弟姐妹和父母中普遍存在:一项对照研究- 对 82 名 ASD 儿童、53 名未受影响的兄弟姐妹、65 名父亲和 70 名母亲以及 52 名无关正常对照的研究。
- 叶酸受体抗体(阻断性或结合性抗体)阳性率:
- 76% 的患病儿童
- 75% 的未患病兄弟姐妹
- 69% 的父亲
- 59% 的母亲
- 29% 的正常对照
- 自身抗体在患病家庭(包括未患病兄弟姐妹)中高度普遍。
Quadros, et al., 2018 Autism Res 11(5):707-712
牛奶与 FR 自身抗体
- Ramaekers 等人 (2008) 发现:消除牛奶可显著降低叶酸受体自身抗体的产生。
Ramaekers et al., 2008 Dev Med Child Neurol 50(5):346-52
检测:叶酸受体自身免疫 (Folate Receptor Autoimmunity Testing)
检测意义
- 一些研究者建议,具有婴儿期 CFD 早期体征和症状的婴儿应检测 FR 自身抗体:
- 易激惹、明显不安、
- 失眠
- 运动发育迟缓伴肌张力低下
- 共济失调的早期迹象
- 自闭症的早期指标
- 癫痫发作
- 倒退
检测实验室:info@iliadneuro.com
CFD 的实验室检查:
叶酸受体自身抗体检测:
- 阻断性抗体 (Blocking antibodies):直接阻断叶酸接触受体
- 结合性抗体 (Binding antibodies):被认为影响受体的整体位置,使得叶酸无法通过进入组织。
- 线粒体功能障碍标志物(活性叶酸进入大脑需要能量)
ASD 中的 FR 自身抗体
- 叶酸受体阻断性或结合性抗体阳性并不意味着孩子患有 CFD 或 CSF 中 5MTHF 水平低;需要进行腰椎穿刺来检测这一点。
- 在两项研究中,分别有 4/23 (17%) 和 1/5 (20%) 儿童存在这种情况。
- 在某些情况下,在咨询医生后,经验性地开始亚叶酸治疗可能是合理的。
腰椎穿刺:(诊断 CFD 的金标准测试)
测量脑脊液中 5MTHF 浓度
- 有创性 - 不常进行
- 患者需要停用叶酸补充剂(包括含叶酸的复合维生素)3 个月,CSF 检测结果才能完全准确。
- 可能需要随时间重复 CSF 测试以测量水平和治疗效果
- 5MTHF 水平处于低“正常”范围的儿童可能有良好的神经学反应。
其他检查
- EEG:常见的发现是广泛性癫痫样放电和背景活动的间歇性减慢。
- 一些儿童表现出视神经萎缩。
- 50% 的 CFD 儿童 CT 和 MRI 完全正常;一些儿童有额颞叶脑萎缩和髓鞘形成延迟。
脑叶酸缺乏症 (CFD) 的治疗
针对叶酸受体自身抗体的治疗
- 未经治疗的 CFD 儿童,其 CSF 5MTHF 水平通常随年龄增长而下降,并且自身抗体的浓度随时间增加。
- 首选亚叶酸 (Folinic acid),剂量为 1 至 2 mg/kg,每天分两次服用,至少一年。
- 5MTHF 应该有效,但尚未在 CFD 中进行研究。
叶酸受体 α 自身免疫与自闭症谱系障碍中的脑叶酸缺乏:一篇综述文章- 对同时患有 ASD 和 CFD 的儿童的研究表明,口服亚叶酸治疗... 导致各种改善,从沟通、社交互动、注意力和刻板行为的部分改善,到神经和 ASD 症状的完全康复。
Rossignol and Frye, 2012 J Ped Biochem 2(4):263-271
Moretti 等人 (2008) 研究摘要- 我们研究了 7 名 CNS 叶酸缺乏症 (CFD) 儿童。两名受试者因严重的神经异常而无法进行正式的行为测试。五名受试者接受了 ADOS 和 ADI-R 测试,并符合自闭症或自闭症谱系障碍的诊断标准。他们表现出转换困难、坚持同一性、不寻常的感觉兴趣和重复行为。语言能力最好的受试者主要使用重复性短语。未发现叶酸转运蛋白或叶酸酶基因突变。本研究未发现头围增长减速。7 名儿童中有 4 名 (57%) 在接受亚叶酸治疗后,认知、运动技能、社交互动、沟通方面表现出一些改善,并且癫痫发作频率减少。
Moretti et al., 2008 J Autism Dev Disord 38(6):1170-7
Ramaekers 等人 (2019) 研究概述- 患有婴儿自闭症的儿童及其父母的一个共同生物标志物是针对位于血脑屏障和胎盘屏障的叶酸受体 α (FRα) 的自身抗体,这会损害生理性叶酸向大脑和胎儿的转移。
- 由于行为干预后的结果仍然不佳,Ramaekers 等人 (2019) 设计了一项研究,用高剂量亚叶酸 (0.5 – 2.0 mg/kg) 治疗叶酸受体 α (FRα) 自身免疫,并结合纠正因异常喂养习惯导致的营养缺乏。
Ramaekers et al. (2019) Infantile Autism with Folate Receptor Autoimmunity and Nutritional Derangements: A Self-Controlled Trial Autism Research & Treatment Volume 2019, Article ID 748643.
研究设计与结果- 所有患有婴儿自闭症的测试对象均接受了常规血液检查:CBC、铁、维生素、辅酶 Q10、金属和微量元素。
- 测量了患有婴儿自闭症的测试对象、其父母和健康对照者血液中的阻断性和结合性 FRα 自身抗体。
- FRα 自身抗体存在于 75.6% 的儿童、34.1% 的母亲、29.4% 的父亲和 3.3% 的健康对照者中。
- 营养缺乏得到治疗,如果 FRα 自身抗体测试呈阳性,测试对象接受高剂量亚叶酸治疗,起始剂量为 0.5 mg/kg,如果 6 个月后无临床反应,则增加至 2 mg/kg,最大日剂量为 50 mg。
Ramaekers et al. (2019) Improving Outcome in Infantile Autism with Folate Receptor Autoimmunity and Nutritional Derangements: A Self-Controlled Trial
- 结果(2年后):
- ASD 对照组儿童 (n=84) CARS 评分(儿童自闭症评定量表)保持不变。
- 接受维生素缺乏治疗外加高剂量亚叶酸的测试对象,其 CARS 评分显著下降至平均值 34.35,表明为轻度至中度自闭症 (p<0.0001)。
- 17/82 名测试对象 (20.7%) 的 CARS 评分降至 30 以下(表明没有自闭症症状)。其中 14/17 名儿童在 5 岁前开始治疗。
- 当发现较高的 FRα 自身抗体滴度、母亲 FRα 自身抗体阳性或父母双方均有 FRα 抗体时,预后变得不太有利。
- 考虑 - 怀孕期间、母乳喂养期间避免乳制品,并在产前、产中和产后对父母使用高剂量亚叶酸治疗。
Ramaekers et al. (2019) Improving Outcome in Infantile Autism with Folate Receptor Autoimmunity and Nutritional Derangements: A Self-Controlled Trial
成人 CFD 成功治疗案例- 怀孕、出生、早期发育正常。3.5 岁时出现痉挛、步态问题和言语困难,并随时间持续恶化。12 岁时,腰椎穿刺显示其脑脊液中活性叶酸 (5MTHF) 非常低。开始每天服用 15 毫克亚叶酸,“不到一周就产生了惊人的效果。” 她可以坐下而不会摔倒,可以上下楼梯,更警觉,对学校更感兴趣。到 14 岁时,她的步态和稳定性得到改善,言语接近正常。
Hansen and Blau, 2005 Mol Genet Metab 84(4): 371-373
亚叶酸改善自闭症和语言障碍儿童的言语沟通能力:一项随机双盲安慰剂对照试验- 48 名患有 ASD 和语言障碍的儿童(平均年龄 7 岁;82% 男性)被随机分配接受 12 周的高剂量亚叶酸(每天 2 毫克/千克,最大每天 50 毫克;n=23)或安慰剂(n=25)。
- 接受亚叶酸的参与者在言语沟通方面的改善...显著大于接受安慰剂的参与者。
- 对于叶酸受体
亚叶酸治疗改善自闭症儿童语言能力的临床研究
- 研究设计:48名自闭症谱系障碍(ASD)儿童随机分组,23人接受高剂量亚叶酸治疗(2mg/kg/天,最大50mg/日),25人使用安慰剂,持续12周[6](@ref)。
- 核心发现:亚叶酸治疗组在言语沟通能力上表现出显著改善(p<0.05),尤其在存在叶酸代谢异常的儿童中效果更突出[6](@ref)。
“当FRα自身抗体(FRAAs)阳性时,亚叶酸治疗的反应率显著提高,表明FRAAs可作为疗效预测标志物。”[6](@ref)
叶酸代谢异常与自闭症的生物学关联
- 脑叶酸缺乏症(CFD)的定义:脑脊液(CSF)中活性叶酸(5MTHF)浓度低于正常值,而血液叶酸水平正常,影响神经发育[6,7](@ref)。
- 致病机制:
- FRα自身抗体(FRAAs)阻断叶酸受体功能,阻碍叶酸穿越血脑屏障[6](@ref)。
- 线粒体功能障碍导致脉络丛能量不足,削弱叶酸转运效率[6](@ref)。
- 基因多态性的作用:叶酸通路基因(如MTHFR、RFC)突变增加自闭症风险,孕前补充叶酸可降低子代发病概率[7](@ref)。
 (示意图:FRα受体功能障碍抑制叶酸入脑)
(示意图:FRα受体功能障碍抑制叶酸入脑)
治疗策略与临床证据
1. 亚叶酸的治疗优势
- 直接以活性形式(5-甲酰四氢叶酸)绕过叶酸代谢障碍,无需MTHFR酶转化[6](@ref)。
- 通过还原型叶酸载体(RFC)进入脑组织,规避被FRα自身抗体阻断的风险[6](@ref)。
2. 疗效验证数据
| 疗效指标 | 亚叶酸组改善率 | 安慰剂组改善率 | P值 | | 语言沟通能力 | 显著提升 | 无变化 | <0.05 | | FRAAs阳性者症状缓解 | 75.6% | -- | <0.01 |
*基于Ramaekers等人(2019)自我对照试验[6](@ref)
关键临床推荐
- 筛查高危人群:对低功能自闭症、倒退型自闭症或伴癫痫的患儿,检测FRα自身抗体及CSF叶酸水平[6](@ref)。
- 治疗剂量:亚叶酸0.5–2.0 mg/kg/天,需持续至少6个月,无效者可增量至最大50mg/日[6](@ref)。
- 协同干预:合并线粒体功能障碍时,联用辅酶Q10、左旋肉碱等能量代谢支持剂[6](@ref)。
[quote]长期预后案例:14岁CFD患者接受亚叶酸(15mg/日)治疗1周后,运动协调性和言语清晰度接近正常水平,证实治疗对青少年仍有效[6](@ref)
|
StarCareHome
本平台医疗信息及相关内容(含个案及研究结论)仅供参考,不构成诊疗、医学建议或疗效保证,相关结论可能存在争议。补剂/药品仅限成分分析(不涉品牌),用户自担使用相关内容、产品及外部链接风险;干预或用药前请咨询执业医师。
|