本帖最后由 StarCare 于 2025-12-4 12:13 编辑
网址:
https://pubmed.ncbi.nlm.nih.gov/24350200/
[size=1.125]综述文章 [size=0.875]前面。公共卫生,2013年9月13日 [size=0.875]儿童与健康部长
自闭症谱系障碍癫痫传统与新颖治疗方法综述:系统综述与专家小组的发现
[size=0.875] Richard E. Frye1* Richard E. Frye1* Daniel Rossignol2 Daniel Rossignol2 Manuel F. Casanova3 Manuel F. Casanova3 Gregory L. Brown4 Gregory L. Brown4 Victoria Martin4 Victoria Martin4 Stephen Edelson5 Stephen Edelson5 Robert Coben6 Robert Coben6 Jeffrey Lewine7 Jeffrey Lewine7 John C. Slattery1 John C. Slattery1 Chrystal Lau1 Chrystal Lau1 Paul Hardy8 Paul Hardy8 S. Hossein Fatemi9 S. Hossein Fatemi9 Timothy D. Folsom9 Timothy D. Folsom9 Derrick MacFabe10 and James B. Adams11 Derrick MacFabe10 and James B. Adams11
- 1阿肯色儿童医院研究所,阿肯色州小石城,阿肯色州
- 阿拉伯数字美国加利福尼亚州尔湾罗西尼奥尔医疗中心
- 3美国肯塔基州路易斯维尔路易斯维尔大学
- 4美国威斯康星州富兰克林自闭症康复与综合健康医疗中心
- 5美国加利福尼亚州圣地亚哥自闭症研究所
- 6纽约大学脑研究实验室,美国纽约州纽约市
- 7美国新墨西哥大学阿尔伯克基分校MIND研究网络
- 8Hardy Healthcare Associates,美国马萨诸塞州兴厄姆
- 9美国明尼苏达大学医学院,明尼阿波利斯,明尼苏达州
- 10加拿大安大略省伦敦市西安大略大学
- 11亚利桑那州立大学,美国亚利桑那州坦佩
尽管癫痫发作常与自闭症谱系障碍(ASD)相关,但针对ASD患者的治疗效果尚未得到充分研究。本稿回顾了传统和新颖治疗ASD相关癫痫的治疗方法。研究通过系统检索主要电子数据库及治疗自闭症患者的专家小组筛选而成。只有少数抗癫痫药物(AED)在自闭症谱系障碍中经过严格控制的试验,但这些试验还考察了癫痫以外的结局。多条证据线表明,丙戊酸酯、拉莫三嗪和左乙拉西坦是ASD患者最有效且耐受的抗兴奋剂。有限证据支持传统的非AED治疗方法,如生酮和改良阿特金斯饮食、多重皮下切开、免疫调节和神经反馈治疗。虽然针对与ASD和癫痫相关的特定遗传和代谢综合征,特定治疗可能更为适用,但很少有研究记录了针对特定综合征癫痫治疗的有效性。有限证据支持L-肉碱、多种维生素和N-乙酰-左半胱氨酸用于线粒体疾病和功能障碍,叶酸用于脑叶酸异常,以及维加巴特林在结节性硬化症中的早期治疗。最后,关于多种新疗法的证据有限,特别是镁与吡哆醇、欧米伽-3脂肪酸、无麸质酪蛋白饮食以及低频重复经颅磁模拟。锌和左旋肉诺酸是潜在的新疗法,但已有基础研究支持,但尚未有临床研究支持。本综述展示了治疗ASD患者癫痫发作的多种治疗方法,以及支持这些治疗的临床试验极为缺乏。关于这些治疗在控制自闭症谱系障碍(ASD)患者癫痫发作方面的更多研究仍然有必要。
介绍多项研究表明,癫痫发作影响了自闭症谱系障碍(ASD)儿童的很大比例。事实上,ASD癫痫的报告患病率范围为5%至38%,明显高于普通儿童人群的1-2%患病率(1–5).一项更大规模的横断面研究显示,2至17岁ASD儿童癫痫的患病率为12.5%,其中青少年的患病率明显最高(6).此外,儿童自闭症谱系障碍中难治性癫痫的患病率被认为高于普通儿童群体(7).有趣的是,近期综述指出癫痫和自闭症谱系障碍(ASD)中认知症状的共同,表明其病因病理生理机制有共同的(8),尤其是当自闭症谱系障碍与智力障碍共存时(9).ASD与癫痫的重叠也得到了研究的支持,这些研究表明,使用抗癫痫药物(AED)治疗ASD儿童可以改善核心及相关ASD症状。 尽管ASD和癫痫患者似乎代表了较大的ASD亚群体,但针对ASD患者的传统癫痫治疗尚未被系统性回顾,潜在的新疗法也未被讨论。尽管任何癫痫儿童的首选治疗是抗癫痫药(AED)疗法,但自闭症谱系障碍患者治疗的疗效差和/或不良反应可能导致采用传统的非AED或新型治疗方法。此外,由于ASD癫痫发作与特定的遗传和代谢综合征相关,针对这些综合征的治疗可能补充传统治疗。 本评论有三个主要目的。首先,为了确定哪些传统治疗癫痫对ASD患者最有效且耐受性良好,本文回顾了传统癫痫治疗有效性的证据(参见传统治疗)。其次,由于ASD中的癫痫发作与特定的遗传和代谢综合征相关,本文会回顾针对这些综合征的治疗,因为它们可能补充传统治疗(参见特定综合征治疗)。第三,由于在有无癫痫发作的自闭症谱系障碍患者中,新型治疗的使用率较高(10)以及在普通自闭症谱系障碍人群中(11回顾了有潜力改善癫痫发作的新疗法(参见新疗法)。总体而言,本综述旨在为患有共病癫痫的ASD患者提供治疗的全面概述,以实现最佳疗效。 方法本次综述采用了问题-干预-比较-结局(PICOs)框架进行(12).目标是识别研究报告有潜力改善临床癫痫发作的治疗方法:(a)ASD和癫痫患者,或(b)患有遗传和/或代谢综合征且ASD和癫痫为显著特征的人群。我们未将这些治疗与其他治疗方法进行比较,并考虑了所有研究设计。我们的首要目标是将临床癫痫严重程度的改善作为主要结局。由于许多针对ASD儿童的治疗,尤其是癫痫治疗,可能会对核心及相关ASD症状产生影响,同时也可能带来不良反应(10),我们还考虑了这些治疗对核心及相关ASD症状的影响作为次要结局。 潜在治疗方法的识别通过多种方式确定了针对自闭症谱系障碍个体癫痫发作的潜在治疗方法。首先,我们检索了标准科学数据库。其次,我们考虑了与自闭症谱系障碍(ASD)和癫痫儿童中常见的代谢和遗传疾病相关的治疗方法。第三,我们考虑了来自两个来源的新疗法:(a)一组定期治疗自闭症儿童且至少参加过三家Elias Tembenis癫痫智库的专家小组(13),以及(b)最近关于家长在自闭症谱系障碍和癫痫儿童及普通自闭症人群中使用的新疗法的调查(10,11). 搜索策略先验制定了该系统综述的前瞻性方案,并选择检索词和筛选标准,试图涵盖所有相关发表。通过计算机辅助检索了PUBMED、Google Scholar、CINAHL、EmBase、Scopus和ERIC数据库,从创立到2013年3月,以识别使用“autism”、“autistic”、“Asperger”、“ASD”、“广泛性发育障碍”和“PDD”等词,并结合“癫痫”、“癫痫”和“癫痫”等词汇的相关出版物。还检索了已识别文献中引用的文献以寻找更多研究。三位作者(理查德·E·弗莱、约翰·C·斯拉特里和克里斯塔尔·劳)筛选了所有潜在相关出版物的标题和摘要。最初纳入的研究包括:(a) 涉及自闭症谱系障碍(ASD)和癫痫或癫痫患者,且 (b) 至少报告过一种癫痫或癫痫治疗。如果文章涉及的动物模型与已知临床综合征不符,则被排除在外;(b) 未发表在期刊上的摘要、海报或会议论文集;(c) 未呈现新的或独特数据(如综述文章或专家选项);或(d)呈现重复数据。 证据水平评级虽然我们曾考虑对已识别治疗方法进行荟萃分析,但由于缺乏标准结局及研究设计的限制,未能对任何已识别治疗进行荟萃分析。作为替代方案,我们根据证据水平为每种治疗提供推荐等级(GOR)。使用成熟量表(14每项研究均被单独评估以确定证据水平,范围从1级到5级(见表)1). 在评估了每种治疗所识别的所有研究后,分配了一个从A(确凿证据)到D(证据有限、不一致或不确定证据)的总评估(见表)2). 由于治疗可能因多种原因获得D的GROR,我们明确指出该治疗是否因证据为单一病例报告或系列(SC)、仅基于实验室研究(BR)、显示中性效应(NE)或可能有害(PD)而获得该评级。若未发现治疗研究,则分配GOR N(无研究)。
[size=0.875]TABLE 1
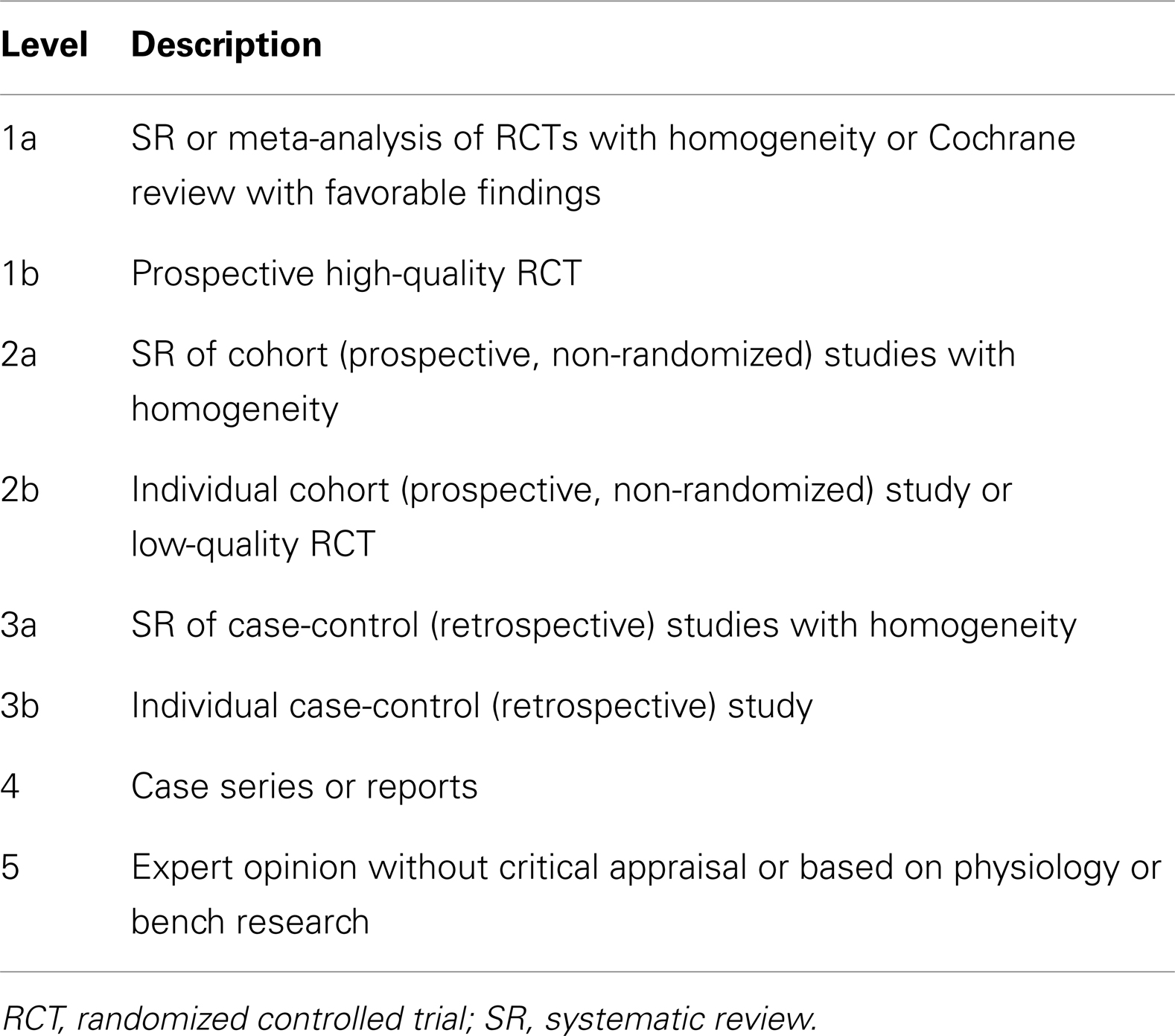 表1。证据水平。
[size=0.875]TABLE 2
 表2。推荐等级。
数据分析与综合我们总结并综合了关于各种治疗方法的信息。首先,表格中提供了:(a) 治疗与自闭症谱系障碍相关的行为和认知症状,(b) 治疗癫痫的一般性,以及 (c) 治疗自闭症谱系障碍和癫痫患者3每种治疗方法及其重要不良反应。也收录在表格中3是最近一项调查研究报告的,报告使用特定治疗治疗的父母百分比(10).通过“传统治疗”、“特定综合征治疗”和“新疗法”三节,详细讨论了这些研究及其评级的推导过程。其次,利用现有证据,我们为患有自闭症谱系障碍(ASD)和癫痫儿童提供治疗建议(见摘要)。第三,我们讨论可能成为未来研究的治疗方法(见摘要)。第四,对ASD患者癫痫治疗研究的优缺点进行了批评(见摘要)。
[size=0.875]TABLE 3
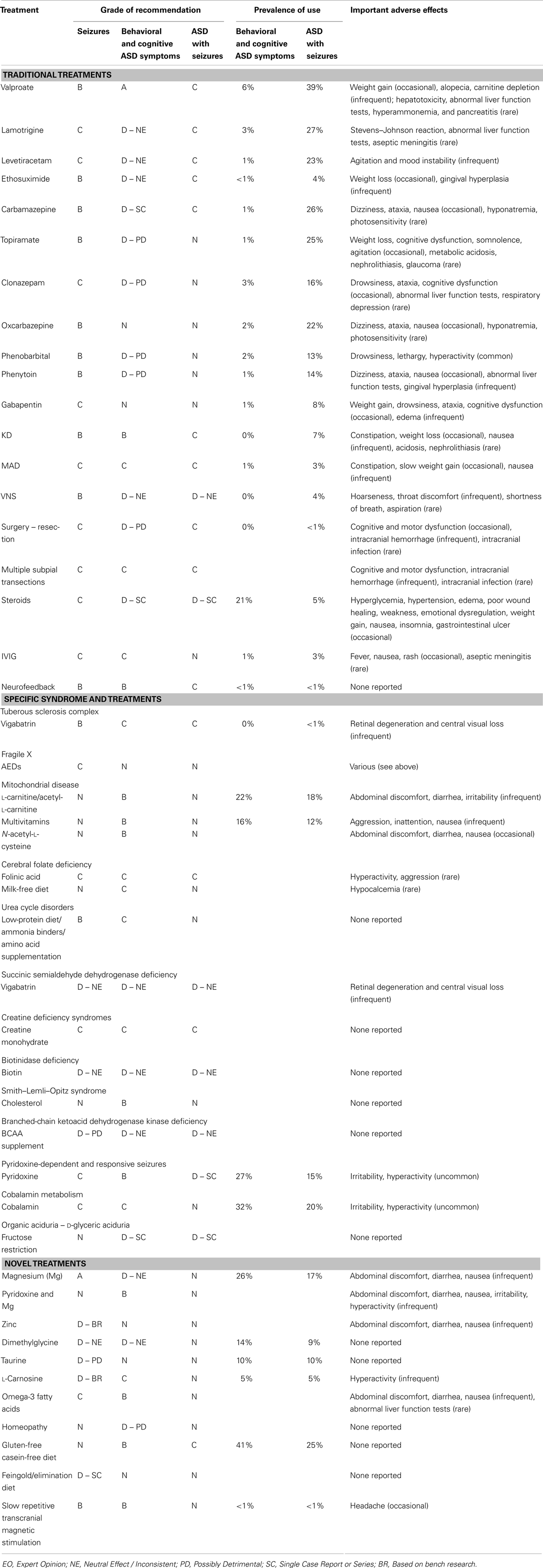 表3。癫痫治疗自闭症谱系障碍。
传统疗法抗癫痫药物抗癫痫药物在自闭症谱系障碍中的疗效目前尚无针对ASD人群癫痫控制的AED的随机对照试验、队列研究或病例对照研究的系统综述。 两项调查研究,一项对照,一项非对照,确定了用于自闭症谱系障碍(ASD)个体癫痫发作的治疗方法。第一项研究于1990年代初进行,收集了北卡罗来纳州自闭症协会838名成员对多种自闭症谱系障碍治疗的反馈(15)(第4级)。受访者列出了用药情况及其对某类药物的总体满意度。总体而言,15.2%的自闭症谱系障碍患者正在接受抗癫痫药,癫痫治疗中最常见的抗癫痫药为卡马西平、丙戊酸和苯妥英,家长对抗癫痫药整体满意。 第二项调查研究是2010年进行的回顾性全国病例对照调查(3b级),确定包括抗癫痫药物在内的多种治疗方法对同时患有癫痫发作和/或癫痫的ASD患者是否比其他治疗更有益。Frye等人(10调查了733名患有癫痫、癫痫和/或异常脑电图(EEG)的ASD儿童家长,以及290名ASD但无这些异常的儿童家长作为对照组。家长评估了传统AED和非AED癫痫治疗及非传统ASD治疗对临床癫痫发作及其他临床因素(包括睡眠、沟通、行为、注意力和情绪)以及三种治疗副作用的感知效应。一项聚类分析表明,治疗可大致分为AED和非AED治疗。对于患有ASD和临床癫痫的儿童,AED治疗平均显示能改善癫痫发作,但加重其他临床因素。在对抗癫痫药治疗进行特异分析时,发现四种抗癫痫药,特别是丙戊酸钠、拉莫三嗪、左甲拉西坦和乙琥胺,在所有检测的抗癫痫药中,发作控制效果最佳,同时加重其他临床因素最少(见图1).其他检测的抗癫痫药物包括苯妥英、氯硝西泮、卡马西平、奥卡西平、托吡酯、加巴喷丁、佐尼沙胺、费巴胺和苯巴比妥。除苯巴比妥外,其他所有抗癫痫药在控制癫痫发作方面效果显著较低,且对其他临床因素影响较差,而苯巴比妥则被评为对其他临床因素影响最差。
[size=0.875]FIGURE 1
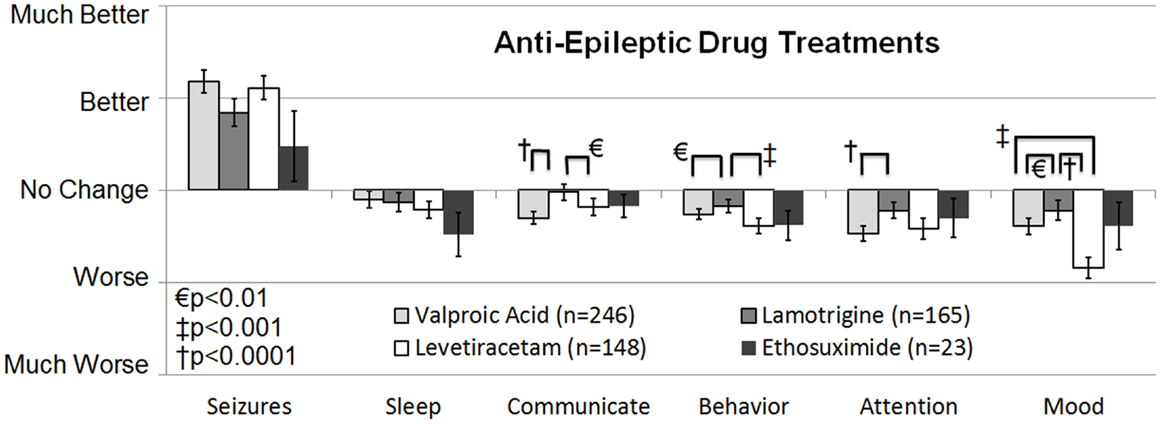 图1。癫痫发作调查评级,针对临床癫痫发作最有利的抗癫痫药物治疗。四种抗癫痫药物对癫痫发作的感知效果无异。在四种治疗中,拉莫三嗪似乎加重了其他几个临床因素,如沟通、注意力和情绪,低于丙戊酸。
在1991年进行的病例系列(4级)中,66名癫痫儿童、50名ASD儿童和16例ASD样症状儿童,Gilbert报告了对丙戊酸盐、卡马西平和乙琥胺的高反应率(不良反应率低)。16).在另一组病例系列(4级),50名儿童(其中28%为ASD)中,拉莫三嗪对癫痫发作有良好效果,尤其是在部分复杂发作和缺神发作中,对强直发作、强直-阵挛发作和肌阵挛发作效果较差(17). 较小的病例报告和病例系列(Level 4)报告称,使用卡马西平在儿童和青少年ASD中癫痫发作频率有所改善(18–20)和拉莫三嗪(17). 因此,有许多低质量(Level 4和3b)研究支持使用丙戊酸、拉莫三嗪、左甲拉西坦、乙琥胺和卡马西平控制ASD患者的癫痫发作,导致这些AED的GOR为C。其他AED如苯妥英、氯硝西泮、奥卡西平、托吡酯、加巴喷丁和苯巴比妥,这些药物在文献中支持不大,且GOR为N。 国际抗癫痫联盟最近对抗癫痫发作初期单药的有效性和疗效进行了系统综述(21).有趣的是,许多抗癫痫药缺乏严格控制的研究支持其作为儿童单用治疗的应用,尽管有更强有力的证据表明其在成人癫痫患者中的使用。收视率见表3这些AED是从本系统综述中抽选的。除左甲西拉西坦、乙琥胺和加巴喷丁外,所有抗癫痫药均从儿童部分发作发作数据中提取。左甲西拉西坦、乙琥胺和加巴喷丁方面没有儿童部分性发作的相关数据,因此采用了其对儿童失神发作疗效的数据。 抗癫痫药物对自闭症谱系障碍的认知和行为影响本节回顾了研究抗癫痫药在自闭症谱系障碍中行为和认知影响的研究。 缬罗酸盐。在随机、前瞻性、双盲、安慰剂对照(DBPC)研究(Level 1b)中,缬戊酸单用药物减少了重复行为(22)和易怒(23,24)在自闭症谱系障碍(ASD)个体中。相比之下,在一项为期8周的随机前瞻性DBPC研究(Level 1b)中,针对攻击性自闭症谱系障碍患者的易怒、攻击性或整体临床状况改善在丙戊酸组与安慰剂组之间无显著差异(25),但许多受试者在开放标签延长期中对丙戊酸保持持续反应,且被逐步停用的参与者表现出症状复发。因此,研究人员认为,较大的安慰剂反应阻止了他们排除真正的丙戊酸效应。该研究的复杂性在于大多数儿童存在显著智力障碍,若患者之前对丙戊酸有阳性反应则被排除,且在进入试验前被逐步停用所有其他精神药物和抗癫痫药物。 据报道,丙戊酸在有癫痫和无癫痫的ASD儿童病例系列(第4级)中改善行为和核心ASD症状(26)并显著改善儿童亚临床癫痫样分泌物(脑电图)病例报告和系列(4级)中的ASD症状(27–32).在一组针对ASD或类似ASD症状及癫痫的儿童的病例系列(第4级)中,Gilbert报告称41%接受丙戊酸治疗的儿童表现出积极的精神活性效果(16).这些研究提供了有力证据,表明丙戊酸盐对ASD患者具有有益的认知和行为效果。鉴于至少两项1b级研究已显示积极效果,且这些发现得到了多项额外研究的支持,丙戊酸在治疗ASD认知和行为症状方面获得了A级评级。 左甲拉西坦。在一项前瞻性开放标签试验(Level 2b)中,左乙拉西坦改善了六名未用药男孩的注意力、多动、情绪波动和攻击行为,但对四名刚戒除精神药物的男孩则无显著改善。33).然而,在一项小型前瞻性随机DBPC(2b级)左甲拉西坦试验中,异常或重复行为、冲动或多动未发现显著改善或恶化(34).因此,目前尚无足够证据表明左旋拉西坦能改善自闭症谱系障碍的行为或认知特征;然而,这些研究表明左旋拉西坦耐受性良好,不会带来负面的认知或行为影响。因此,左白拉西坦的总质量指标为D至NE,以保证对ASD认知和行为症状的中性效果。 拉莫三嗪。拉莫三嗪在一项小型前瞻性、随机、DBPC(2b级)研究中未改善或恶化异常行为或自闭症谱系障碍(ASD)(35但在一个包含50名儿童(28%为ASD)的病例系列(第4级)中,家长报告称拉莫三嗪在62%患有难治性癫痫的ASD儿童中认知和ASD症状有所改善,即使发作频率未改善(17).尽管拉莫三嗪可能在非ASD癫痫患者中提升认知能力(36)并且对双相情感障碍的情绪稳定具有有效效果(37目前尚无足够证据表明它能改善自闭症谱系障碍的行为或认知特征;相反,这些研究表明拉莫三嗪对自闭症谱系障碍(ASD)个体几乎没有负面的认知或行为影响。因此,拉莫三嗪的总质量(GOR)为D至NE,以保证对自闭症谱系障碍个体认知和行为症状的中性效果。 托吡酯。在自闭症谱系障碍患者中,托吡酯与利培酮结合使用,可减少易怒、刻板行为和多动,DBPC(2b级)研究显示(38但在开放标签研究(Level 4)中,部分参与者却出现了行为不良反应(39).鉴于结果不一致以及托吡酯可能对癫痫患者产生神经认知不良反应(40托吡酯可能仅对特定ASD个体的行为治疗有帮助。因此,托吡酯被评为D至PD的总质量,以评估ASD儿童认知和行为症状可能产生的不良影响。 其他抗体解药。在一个病例系列(4级)中,针对ASD或ASD样症状和癫痫的儿童,Gilbert报告称56%接受卡马西平治疗的儿童表现出积极的精神活性效果(16). 因此,卡马西平的总质量评分为D至SC,因为证据仅限于单一病例系列。在一项回顾性病例对照调查(3b级)中,家长评定乙琥胺是四种对行为和认知影响最小的抗癫痫药之一,但未评定认知或行为症状改善(10). 因此,乙琥胺在ASD中对行为和认知具有中性作用,其总值为D至NE。 在一个病例系列(第4级)中,66名癫痫儿童、50名ASD儿童和16名ASD样症状儿童,Gilbert报告称氯硝西泮、苯妥英、苯巴比妥和硝西泮极其负面的行为不良反应发生率较高。16). 鉴于苯妥英、氯硝西泮和苯巴比妥在一项回顾性病例对照调查(3b级)中被评为对自闭症儿童行为和认知有不良影响的抗癫痫药物组(10),这些AED因可能对ASD的行为和认知症状有害,获得了D至PD的总检定。 传统非抗癫痫药物治疗生酮与改良阿特金饮食生酮饮食(KD)在治疗癫痫方面有着悠久且成功的历史,尤其是在抗癫痫难治性癫痫方面,一些研究人员建议将其作为一线治疗。多项针对癫痫儿童进行的非盲但随机对照试验(Level 2b)报告显示其效果与抗癫痫药(AED)相当(41),导致癫痫治疗的总质量为B。由于长期依从性较大,脂肪含量极高(占热量的90%),有时会采用改良型阿特金斯饮食(MAD),以改善患者的长期依从性。针对儿童和成人癫痫的研究显示,KD和MAD(2b级)的疗效相似(42),导致MAD在扣押控制中获得了C的总质量(GOR)。在一项回顾性病例对照调查研究(3b级)中,KD被评为改善癫痫发作最有利的非抗癫痫药物,并且在其他与ASD相关的重要临床因素上也被评为有益(见图)2) (10).此外,一项小型前瞻性、非对照研究显示,ASD症状改善(2b级)表现出积极的响应率(43).另一项近期病例报告(Level 4)显示,KD显著改善了一名12岁ASD女孩的癫痫发作(44).因此,KD在治疗ASD认知和行为症状时获得Gor B,在治疗ASD患者的癫痫方面获得GOR of C。MAD在回顾性病例对照调查研究(3b级)中也获得了对癫痫及其他行为和认知ASD症状控制的好评,尽管不如KD好评(10).因此,MAD在治疗行为和认知ASD症状以及控制ASD个体癫痫发作方面,获得了C级的GROR。总体而言,这些都是治疗自闭症谱系障碍患者癫痫发作的有前景干预措施,尤其是在耐药性癫痫患者中。显然需要更多研究。
[size=0.875]FIGURE 2
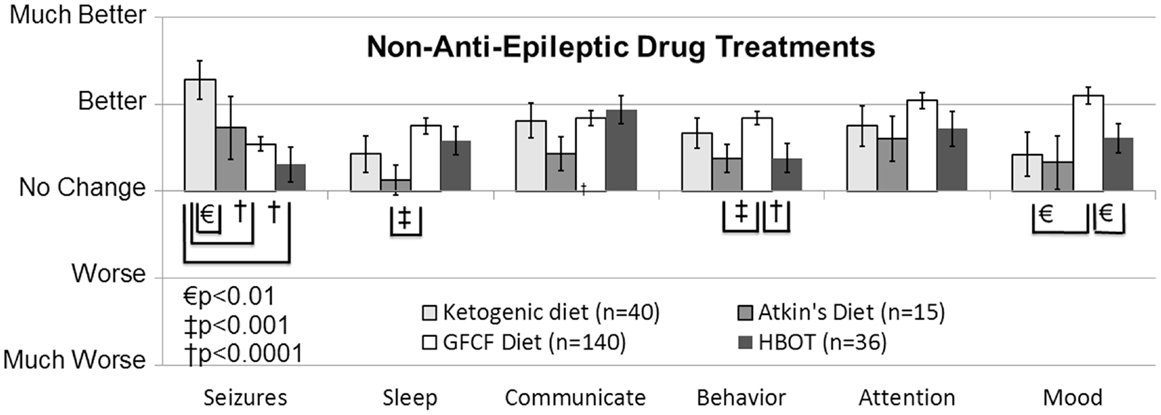 图2。临床癫痫发作中评价最优的非抗癫痫药物治疗的癫痫发作调查评分。生酮饮食被认为比无麸质酪蛋白饮食和高压氧治疗更能改善癫痫发作。除行为、睡眠和情绪外,其他临床因素在这四种治疗间无显著差异,而无麸质酪蛋白饮食相比其他治疗效果显著更好。
迷走神经刺激器在成人和青少年耐药性癫痫患者中,迷走神经刺激器(VNS)已被随机对照研究(Level 2b)显示能降低癫痫发作频率(45),导致癫痫控制的总质量(GOR)为B。对59名接受VNS治疗的ASD患者进行回顾性综述发现,超过一半的患者癫痫发作频率至少减少了50%,且超过一半表现出显著的生活质量改善(4级)(46). 被报道,VNS能改善阿斯伯格综合征和双颞部癫痫(4级)成人的癫痫发作和行为(47). 然而,一项针对8名患有医学难治性癫痫和自闭症谱系障碍儿童和青少年的前瞻性试验未发现癫痫发作频率或认知能力的改善,且不到一半的病例在整体功能(2b级)方面表现出轻微改善(2b级)(48). 最后,在病例系列中,9名治疗难治性癫痫和ASD患者中仅有2人在VNS(4级)下表现出有限改善(49).鉴于这些相互矛盾的结果,VNS在治疗癫痫及自闭症谱系障碍个体的认知和行为症状方面获得D至NE的中性效果。鉴于VNS需要手术植入,可能导致并发症,在其他癫痫治疗失败后,谨慎考虑对患有自闭症谱系障碍(ASD)和难治性癫痫的儿童进行VNS治疗可能是明智的。 手术一般来说,最有效的常规癫痫手术是切除癫痫灶性明显出现的皮层区域。有些简单的情况是磁共振成像清晰可见潜在癫痫灶,如结节性硬化综合体(TSC)和肿瘤,尤其是颞叶肿瘤(50–52).然而,即使视觉化了焦点,确认癫痫焦点也至关重要。对于没有磁共振成像确认焦点的个体,需要进行癫痫灶定位的程序,如脑磁图(MEG)、硬膜下颅内记录网格和/或术中定位。鉴于在外科人群中进行盲法或病例对照研究的困难,系统性综述已审查了许多病灶手术结局的病例系列(第4级)。53).因此,癫痫手术总体上被评为C级,因为多项四级研究证明了其有效性。 多个病例系列研究了ASD和难治性癫痫儿童在癫痫手术后ASD症状和认知的变化。在五例局部病灶切除儿童中,仅通过神经心理测试确认改善,另一名儿童明显恶化(4级)(54).在一组两名患有局灶性癫痫和TSC样病变的男孩病例中,只有一名儿童明显改善,但仅在手术多年后(4级)。(55).在24例癫痫手术中,7名ASD儿童均未改变诊断或智力(4级)改善(56).在另一组包含60名儿童的病例中,其中38%患有自闭症谱系障碍(ASD),为控制癫痫发作而进行颞叶切除术,但整体精神诊断(Level 4)未发生改变(57).然而,在另一组16例患者中,其中5名患有自闭症谱系障碍(ASD),其中3名ASD患者表现出积极的行为改变,而1名ASD患者没有变化,另有1名患者加重(4级)(58).因此,有多项四级研究表明,标准癫痫手术(即切除术)并不能持续改善自闭症谱系障碍(ASD)的症状或认知,反而可能导致行为和认知结果恶化,因此该手术因潜在有害性而被评为D至PD的总质量(GOR)。 在一些患有自闭症癫痫样回归(AER)的儿童中,已经研究了多重皮下切断(MSTs)。59–61但这种手术并不常见。在MST后有两名AER儿童(4级)中报告了良好结果(59但稍大病例系列表明任何改善都是有限且暂时的(4级) (61).MST在一组病例系列(4级)中报告了令人印象深刻的结果,涉及18名患有ASD的儿童,他们接受了包括MEG在内的广泛术前皮质电图检查,以指导硬膜下网格放置(Level 4)(60).大多数病例发现有多个独立灶性,需在多个皮层区域进行MST,所有儿童也接受类固醇治疗。在该系列中,4名儿童分别表现出重大、中度和轻微改善。没有任何儿童表现出恶化。后者研究表明,当MST与类固醇联合应用于多焦点时,可以获得最佳效果。MST因改善ASD儿童的癫痫发作和行为症状,尤其是AER亚组,获得Gor C级评价,因为多个病例系列支持这一观点。MST已被证实在多个病例系列(4级)中,对无ASD难治性癫痫儿童的癫痫减少发作有效(62–64),导致总质量为C。 免疫调节治疗免疫调节治疗,特别是类固醇和静脉注射免疫球蛋白(IVIG),已被用于治疗许多耐药性癫痫综合征以及被认为具有自身免疫基础的癫痫综合征。此类治疗在兰道-克莱夫纳综合征和慢波睡眠期间持续尖波活动中尤为有效,这两者都是与ASD部分特征相似的综合征。 尽管类固醇在治疗自闭症谱系障碍(ASD)中相对常见(见表)3),仅有两例(4级)儿童脑电图正常且非癫痫自闭症回归报告在皮质类固醇治疗后语言和行为有所改善(65,66).研究已证实,类固醇治疗与MST联合使用,在一组ASD及亚临床癫痫样分泌物(Level 4)儿童中,对癫痫发作和脑电活动的改善有积极效果(60)以及在一项开放标签前瞻性研究(Level 2b)中与valproic acid联合使用(Level 2b)(67).因此,针对ASD患者的ASD行为和癫痫治疗,类固醇治疗的总质量指数为D至SC,因为其有效性报告有限。类固醇已被证实在多个病例系列(4级)中,对无ASD难治性癫痫儿童的癫痫发作效果显著(68,69),导致总质量为C。 相对较大的病例系列(4级) (70)以及采用标准化治疗方案的病例系列(第4级)71)已记录IVIG在无癫痫的ASD儿童中有益,其中一项研究显示停止IVIG治疗后会有回归效果(70).相比之下,其他较小的案例系列(4级) (72)和案例系列(第4级)使用非标准化协议(73)未能确认这些改善(总体GC在ASD症状治疗中的效果)。尽管IVIG在耐药性癫痫中并不罕见,但其疗效的证据仍以病例系列(4级)为证(74–77)(总体上,C的总质量标准(GOR)用于癫痫发作治疗。IVIG治疗在ASD癫痫发作中获得的总质量评分为N,因为目前没有相关报道将其用于此情境。 神经反馈神经反馈是一种安全的治疗方法,利用作性条件反射来增强易发发作和非易发发作脑区之间的连贯性。连贯信息被整合进听觉、视觉或视听游戏中。患者通过提升选定脑区之间的一致性来成功(78).两项近期荟萃分析(Level 3a)表明,神经反馈能够减少大多数患者的癫痫发作,即使是在其他方面未受控的癫痫患者中(79,80支持Gor B。研究表明神经反馈可能是ASD儿童有效的认知疗法(78)以及一项最新综述列出了七项对照研究(81)至少有三项前瞻性研究,使用非盲候补名单对照组(82–84)(2b级)。因此,使用神经反馈治疗ASD的行为和认知症状时,在治疗ASD症状时获得B级的总质量(GOR)。多个病例研究表明,它可能对ASD(4级)癫痫发作障碍有帮助(85–87),支持一个C的GR。 特定综合征的治疗自闭症谱系障碍与多种代谢和遗传综合征相关,其中至少部分病理生理机制已知。其中一些综合征的治疗方法可能改善其潜在的病理生理过程,从而减轻相关的癫痫发作。本节回顾与ASD和癫痫相关的遗传和代谢疾病,并讨论潜在的治疗方法。 结节性硬化症复合体在一例中,维加巴特林是一种γ-氨基丁酸(GABA)转氨酶抑制剂,能提高大脑中GABA浓度,被发现对ASD(4级)TSC患者的婴儿痉挛和部分癫痫特别有效(88).维加巴特林还改善了部分患者在该病例系列(4级)中的核心ASD症状(88).在两例病例系列(第4级)中,癫痫发作后立即开始服用维加巴特林相比延迟使用维他巴特林(Level 3b)降低了出现ASD症状的风险(89,90).在一项病例报告(4级)中,一名TSC儿童在停止维伐嗪治疗后表现出AER,表明持续使用维他巴特林可能预防了ASD的发展(91).由于多个病例系列和报告已记录维加巴特林对癫痫发作(尤其是婴儿痉挛)以及自闭症谱系障碍(ASD)认知和行为症状的潜在益处,该治疗在ASD症状和癫痫发作中均获得C级高质量(GOR of C)评级,尤其是在生命早期开始时。一项小型前瞻性、随机、多中心对照试验(1b型)已证明维加巴特林对TSC婴儿痉挛的有效性(92),导致TSC中查获控制的总质量为B。 脆弱的X号脆性X型是最常见的遗传自闭症综合征,约占自闭症谱系障碍病例的1%至5%。93).兴奋性代谢性谷氨酸受体与抑制性GABA受体之间的失衡被认为是脆性X综合征中许多行为、认知和癫痫样症状的原因。尽管在脆弱X型中癫痫发作似乎较为常见(患病率为10–20%),但病例系列和调查研究(第4级)表明,通常可以通过标准的抗癫痫药治疗轻松治疗(94–97).小鼠模型(Level 5)已证明,新型谷氨酸受体调节剂,如反激动剂2-甲基-6-(苯乙基)吡啶(98),以及GABA激动剂,如巴克洛芬和甘诺索隆(99),可以提高癫痫发作阈值。类似的方法也被用于临床试验中治疗脆弱X患者的ASD症状(100).此外,小鼠模型(Level 5)已证明,其他新疗法如洛伐他汀可以减少过量的海马体蛋白合成,从而减少癫痫发生率(101)以及用糖原合酶激酶-3抑制剂解决中枢代谢调节异常可以减少癫痫发作(102). 线粒体疾病与功能障碍线粒体功能障碍似乎是ASD中最常见的代谢障碍之一(103).最早描述与ASD相关的线粒体疾病(MD)之一是HEADD综合征,这是一种肌张力低下、癫痫、自闭症和发育迟缓的关联,在一系列患有呼吸链障碍的ASD儿童中被描述(104).据估计,41%的自闭症谱系障碍(ASD)和多重症儿童中会出现癫痫发作(103). 目前尚无系统性研究针对患有多重心病(MD)儿童癫痫发作的治疗方法,无论是否伴随ASD(105,106).患有ASD和MD的儿童接受过多种MD治疗,包括肉碱、辅酶Q10、B族维生素以及维生素C和E(107).受控研究显示,某些标准治疗MD能改善ASD的核心及相关症状。有趣的是,这些治疗方法并未经过严格的研究,主要基于专家意见。在自闭症谱系障碍中研究过用于MD的治疗包括两项DBPC研究中的l-肉碱(Level 2b)(108,109)导致ASD症状的总质量(GOR)为B;含有B族维生素、抗氧化剂、维生素E和辅酶Q10的多种维生素,均在两项DBPC研究中(Level 2b)(110,111)导致ASD症状的总质量(GOR)为B;以及N-乙酰-l-半胱氨酸在两项DBPC试验中(Level 2b)(112,113)以及病例报告(第4级)(114) 导致总质量为 B。虽然目前尚不清楚用标准治疗MD改善癫痫发作的疗效,导致癫痫的总质量为N,但合理推测改善线粒体功能可能减少癫痫发作。 叶酸代谢异常叶酸对多种重要代谢过程至关重要,包括氧化途径、同型半氨酸代谢和基因甲基化(115).这些过程的任何中断都可能导致发作的风险增加。ASD与多种多态性相关,这些多态性可能减少5-甲基四氢叶酸(5MTHF)的产生,并妨碍叶酸通过血脑屏障及神经元的运输,包括亚甲基四氢叶酸还原酶的多态性(116–125)、二氢叶酸还原酶(126),以及还原叶酸载体(117).更重要的是叶酸受体α(FRα)功能障碍,损害了5MTHF穿越血脑屏障的运输能力(127).该运输系统可被FRα自身抗体阻断,该抗体可能存在于大多数ASD儿童中(127,128)或在患有多重症谱系障碍的自闭症儿童中可能出现功能障碍(129).携带FRα自身抗体的个体通常需每天服用0.5–2 mg/kg的叶林酸,而患有MD的人可能需要4+ mg/kg/天的叶林酸。此外,一项对照研究也显示无牛奶饮食能降低血清FRα自身抗体滴度(130).多个小病例和大型病例系列(Level 4)已证明,针对患有FRα自身抗体的ASD儿童,叶酸治疗可部分改善沟通、社交互动、注意力和刻板行为(127,130–133)到ASD症状的完全康复(132,134),导致ASD症状的总质量为C。两个病例系列(4级)在接受叶酸治疗后,ASD和脑叶酸异常儿童的癫痫发作有所改善,导致ASD和癫痫发作的GCR为C(133,134).在多个病例报告和病例系列(4级)中,叶林酸已被证明能治疗一种称为叶酸反应性癫痫的难治性癫痫(135,136),其癫痫的总质量(GOR)为C。有趣的是,叶酸反应性癫痫综合征现已被理解为与吡哆醇反应性癫痫有重叠(137).无奶饮食已被证明能降低FRα自身抗体的血清浓度,并改善ASD的易怒性(Level 2b),因此ASD症状的GER为C。无奶饮食尚未研究过有或无ASD(N的全谱系或大质量)儿童癫痫发作的研究。 尿素循环障碍两例患有尿素循环障碍的ASD儿童病例,其中一例伴有鸟氨酸转氨酰酶缺乏和精氨酸酶缺乏症(138)以及另一个因氨甲酰磷酸合成酶缺乏症(139)迄今为止已报道。标准治疗侧重于通过低蛋白饮食和氨结合剂来减少氨,同时补充特定氨基酸和各种维生素补充剂(140).这些病例报告中,ASD症状在治疗后(4级)有所改善,导致GOR为C。这两例均未发生癫痫发作,导致自闭症谱系障碍和癫痫发作的全能性质谱系(GOR)为N。在大型队列(2b级)和病例系列(4级)研究中,标准治疗显示尿素循环障碍患者的癫痫发作和神经症状有所改善,导致GOR为B(141). 琥珀半醛脱氢酶缺乏症琥珀酸半醛脱氢酶缺乏症是一种罕见的GABA代谢常染色体隐性疾病,包括ASD特征和癫痫发作(142).在缺乏琥珀酸半醛脱氢酶的情况下,GABA通过一种替代途径降解,该途径产生γ-羟基丁酸。维加巴特林抑制琥珀酸半醛的形成,但在控制癫痫和认知改善方面表现不稳定,导致结果不一致时的胃反应指数为D至NE(142). 肌酸缺乏综合征肌酸和磷酸在高能磷酸的储存和传递中起着重要作用。三种先天性肌酸代谢障碍,统称为肌酸缺乏综合征,包括发育迟缓、退化、自闭症谱系障碍特征、智力障碍、语言障碍、运动障碍和癫痫发作(143).多个病例系列(4级)和病例报告(4级)已记录,肌酸缺乏症可以通过高剂量肌酸单水合物以及限制和补充特定氨基酸(氯的总质量素)来治疗(141). 生物素酶缺乏症生物素(维生素B7)代谢障碍表现为癫痫发作和发育迟缓。据报道,一名ASD儿童存在部分生物素酶缺乏症,但对生物素补充无反应(4级)。然而,同样表现出部分生物素酶缺乏症状的弟弟,由于早期开始治疗(4级),他并未发展为ASD(144).尚未有文献证实补充生物素能改善生物素酶缺乏症的癫痫发作(141).因此,生物素在癫痫发作、ASD症状和ASD癫痫发作中具有中性作用,获得了D至NE的总质量。 史密斯-莱姆利-奥皮茨综合征许多(50–75%)的Smith–Lemli–Opitz综合征儿童符合ASD的标准(145,146).在病例报告中,针对患有史密斯-莱姆利-奥皮茨综合征的儿童补充胆固醇治疗已被报道改善自闭症谱系障碍及其相关行为症状(147)(4级),病例系列(148)(4级),以及潜在的队列(149,150)(2a级),尤其是在幼儿中(151),尽管一项针对主要儿童和青少年的短期DBPC(2b级)试验未能证实这些发现(152).因此,针对患有史密斯-莱姆利-奥皮茨综合征的幼儿,行为自闭症谱系障碍症状的胆固醇补充会获得B级的胆固醇补充。对于有无ASD导致睾酮N的儿童来说,针对史密斯-莱姆利-奥皮茨综合征的控制,尚无胆固醇补充的研究。 分支链酮酸脱氢酶激酶缺乏症在两个患有自闭症谱系障碍、癫痫和智力障碍的近亲家族中,发现了分支链酮酸脱氢酶激酶基因的失活突变。该突变导致分支链氨基酸水平降低。采用富含分支链氨基酸的饮食治疗,导致小鼠模型中的神经异常逆转(Level 5),并在一组病例系列(Level 4)中氨基酸正常化,但临床上无改善(153).有趣的是,斯特拉斯堡一项针对遗传性失神癫痫大鼠的研究(一个广泛性非痉挛性癫痫(Level 5)遗传模型,报告了腹腔注射分支链氨基酸后癫痫发作增加,推测是由于这些氨基酸在谷氨酸代谢中的作用(154).因此,饮食中氨基酸富集可能不应用于癫痫,因为可能带来不良影响(如D的GOR,PD的潜在有害),且应在已知的分支链酮酸脱氢酶激酶缺乏的背景下谨慎考虑,因为ASD症状和/或癫痫改善的证据不足且与动物模型不一致(Gor of D – NE for 不一致)。 吡哆醇依赖性和吡哆醇反应性癫痫发作吡哆醇是110多种酶的辅因子。吡哆醇对治疗患有吡哆醇依赖性或吡哆醇反应性癫痫发作的儿童有效(155–158).吡哆醇在吡哆醇依赖性和吡哆醇反应性癫痫发作中的疗效已被多例(Level 4)记录(159),导致总质量为C。当怀疑吡哆醇依赖性和吡哆醇反应性癫痫发作时,需注意吡哆醇(am)ine phosphate oxidase 缺乏症和新生儿/婴儿低磷酸症属于鉴别诊断,同时应考虑叶林酸联合治疗并采用赖氨酸限制饮食(159). 吡哆醇代谢异常的概念首次被提出是在色氨酸负荷测试中发现一组ASD儿童表现出与吡哆醇依赖酶相关的异常时(160).多项开放标签试验显示维生素B6(161,162).例如,在一项大型开放标签(2b级)研究中,ASD儿童在服用含高剂量(150–450毫克)吡哆醇的维生素组合后,整体表现显著改善162).一项小型随机DBPC交叉变量剂量(75–3000毫克)停药研究(Level 2b)显示,显著更多ASD儿童在吡哆醇治疗下改善率显著高于安慰剂组(20%)(163).一项DBPC交叉试验(Level 2b)评估吡哆醇及其他多种ASD症状治疗方法,但与基线相比,吡哆醇的疗效未被证明(164).然而,后者研究可能存在缺陷,因为它没有将唯一的吡哆醇组与安慰剂进行比较。因此,吡哆醇在治疗行为和认知ASD症状时获得B级的GCR评分。然而,支持将吡哆醇与镁联合用于治疗ASD症状的观点更为充分(见下文部分)。 迄今为止,已有一例ASD病例报告,涉及严重智力障碍、吞气、屏气、自残及吡哆醇依赖性癫痫发作(165).根据该报告,高剂量吡哆醇改善了癫痫发作,但无法测量其是否改善了ASD特征(4级),因此吡哆醇在治疗ASD患者的癫痫发作时获得了D至SC的总值。 钴胺代谢异常钴胺素缺乏与癫痫发作的关联较少(166,167),最常见的表现包括巨型白细胞性贫血、喂养困难、发育迟缓、小头症、发育不良、肌张力低下、嗜睡、易怒、不自主运动和脑萎缩。癫痫发作可能是局灶性、多灶性和/或肌阵挛性(166,167),可能在治疗开始后出现(166)并且在许多病例报告中,钴胺补充剂已得到改善(Level 4)(166,167).因此,在鈷胺素缺乏情况下,针对癫痫发作补充钴胺素的总质量(GOR)为C。 研究显示,患有ASD的儿童在鈷胺素(维生素B12)依赖性代谢方面表现出异常(117).一项近期前瞻性开放标签研究(Level 2b)表明,在服用3个月的甲钴胺注射剂和口服叶林酸补充后,ASD儿童的谷胱甘肽代谢可改善,但甲基化不会发生。168).该研究未报告该疗法对自闭症谱系障碍认知或行为的影响,但一项小型前瞻性开放标签研究(Level 2b)显示,甲基钴胺注射在核心ASD症状以及智力和发育指数方面均有显著改善(169).因此,钴胺素在治疗ASD的行为和认知异常时获得的GOR为C,而在ASD患者中癫痫发作时的GOR为N,因为目前尚无相关研究支持。 有机酸尿症尽管在病例研究中,有几种有机酸尿症被报道与ASD相关,包括D-甘油酸尿症(170),丙酸血症(171以及L-2-羟基戊二酸尿症(172),只有D-甘油酸尿症与癫痫发作有关(170).在后者病例报告中,癫痫发作和自闭症症状在果糖限制下有所改善(170).由于仅在本病例中报道了果糖限制剂的使用,该疗法在治疗ASD症状和癫痫方面获得D至SC的GOR为D至SC,癫痫则获得N的GOR,因为目前尚无支持此类治疗的研究。此外,由于此类疗法针对特定有机酸尿症,不太可能成为治疗自闭症谱系障碍(ASD)或其他代谢疾病癫痫的新疗法候选。 新颖的处理方法考虑到新疗法在自闭症谱系障碍人群中的广泛应用(10,11,173),对癫痫控制中的辅助治疗等治疗的讨论值得考虑。这里我们回顾了一些在自闭症谱系障碍中常用且有治疗癫痫证据的新疗法。 镁(mg)离子化Mg(Mg2+)对N-甲基-d-天冬氨酸受体具有拮抗作用(174,175镁缺乏可能是多种癫痫的因素之一(176–178). 有研究认为,低Mg2+或Mg2+与离子钙(Ca2+)平衡改变,可能诱发癫痫发作(179). 研究表明,癫痫患者的平均Mg2+水平显著较低,且Ca2+/Mg2+比值升高,尽管血清总Mg水平正常(180). 研究表明,Mg能减少特发性癫痫发作持续时间,持续时间的缩短与发作严重程度成正比(181). 一项对羟考试验(1a级)关于硫酸镁(MgSO4)用于子痫发作预防和管理的综述显示,其作为标准治疗的证据压倒性地证明了(182). 在一项针对婴儿痉挛的小型开放标签研究(Level 2b)中,向ACTH添加MgSO4改善了癫痫发作的缓解率(183). 一项小型回顾性病历回顾(第4级)显示,辅助口服Mg治疗显著改善了难治性癫痫患者的癫痫发作频率(184). 根据病例系列,Mg已被推荐作为癫痫状态的二线治疗(Level 5)。(185)并被报道在治疗两名患有青少年发病阿尔珀综合征(4级)的难治性癫痫患者中具有治疗效果(186). 镁作为治疗癫痫的有力证据导致了A级的总检验。 在自闭症谱系障碍儿童中,镁与吡哆醇联合使用作为新疗法,单独使用镁用于便秘治疗,但临床研究较少。在一项DBPC交叉研究(2b级)中,镁与安慰剂的比较显示,治疗ASD症状效果不一(164). 鉴于结果不一,Mg在治疗ASD症状时效果不一致,获得了D至NE的GCR评分。Mg补充尚未在患有癫痫导致GOR为N的ASD儿童中进行研究。然而,鉴于Mg在其他癫痫发作疾病中也有帮助,有望帮助同样有癫痫发作的ASD儿童。 吡哆醇和镁联合治疗一项早期研究显示,吡哆醇和Mg联合使用在ASD儿童中具有积极行为效应,这是一项中等规模的开放标签研究(Level 2b)(187).在一项混合设计研究中,约34%的ASD儿童在初始开放标签阶段研究中表现出反应,其反应在后续DPBC阶段(Level 2b)中得到验证(188).在一个相当复杂的中等规模DBPC交叉设计(Level 2b)中,吡哆醇和Mg的联合被证明优于单独治疗及安慰剂(164).然而,较新的小型DBPC研究(Level 2b)尚未发现高剂量的效果(189)或低剂量(190)针对自闭症儿童的联合治疗。一项近期的非对照(Level 4)研究显示,吡哆醇、镁和核黄素的联合使用显著降低了自闭症儿童尿液二羧酸的水平(191).吡哆醇和Mg联合治疗尚未用于有ASD或无ASD儿童的癫痫,尽管单独使用过各成分(见上文)。因此,无论有没有ASD的癫痫,这种组合的总质量(GOR)均为N。最近一项针对ASD新疗法的综述表明,这种联合疗法在仔细监测下是可接受的(173根据上述研究,该组合在自闭症谱系障碍中认知和行为症状方面获得B级总质量。鉴于这些疗法可能对部分患有自闭症谱系障碍和癫痫的儿童有益,联合疗法可能有益,应进一步研究。 锌两项最新研究表明,ASD儿童的血浆锌(Zn)水平会降低(192,193),而另外两项研究则未支持这一发现(194,195).锌对免疫、激素、抗氧化剂、遗传、神经和生理过程至关重要。病例对照研究中,已在发热性癫痫儿童的血清和脑脊液中发现了低锌水平(196,197)并在一项包含40名患者的病例对照研究中与成人癫痫相关,且与健康对照组匹配(198)以及一项针对70名年龄、族裔和社会经济地位匹配参与者的病例对照研究中,也发现了特发性难治性癫痫(199).尽管锌已被证明能缩短内侧颞叶癫痫(5级)患者产生的齿状颗粒细胞的兴奋反应持续时间(200)并降低EL小鼠模型(Level 5)中的癫痫易感性(201),尚未进行任何癫痫临床试验。因此,由于证据仅基于实验室研究,癫痫治疗被评为D至BR的GOR。尽管目前尚无证据支持锌补充剂用于治疗ASD癫痫或改善ASD的行为和认知(NOR of N),但鉴于锌在神经功能中的重要作用、支持性的实验室数据以及ASD儿童可能已有缺乏的事实,锌补充可能是未来值得研究的重要新疗法。 二甲基甘氨酸关于二甲基甘氨酸(DMG)对癫痫发作的疗效报告不一。在单受试者重复测量设计(Level 4)中,一名22岁患有智力障碍和难治性癫痫的男性,使用90毫克每日两次DMG,显著减少了癫痫发作(202).然而,小型临床试验尚未验证DMG的有效性。在DBPC交叉研究(Level 2b)中,5名难治性癫痫发作患者在1个月内每天服用270毫克DMG,发作频率未见减少(203).在一项DBPC研究中,对20名智力障碍和癫痫患者在研究前两周每天服用300毫克DMG,后两周(Level 2b)每天600毫克治疗,对照组与治疗组间未发现癫痫发作频率减少(204).DMG因癫痫治疗证据不一致,获得了D至NE的GROR。DMG已在两个小型DBPC(2b级)儿童ASD儿童中评估,均未显示对ASD症状有显著益处(205,206).DMG因有效治疗ASD症状证据不一致,获得D至NE的GROR。DMG尚未在ASD和癫痫儿童中进行对照研究,因此其高质量(GOR)为N。这些证据不支持进一步研究DMG作为ASD和癫痫患者新疗法的应用。 牛磺酸牛磺酸是一种含硫有机酸,可能具有神经保护和神经调节特性。牛磺酸被提出是一种弱GABAA和GABAB受体拮抗剂,具有潜在的抗癫痫活性(207–211但其穿越血脑屏障的能力是有限的(212)且尚无研究确定牛磺酸是否能有效治疗癫痫(213).两项研究发现,ASD儿童的血浆牛磺酸水平显著低于对照组(195,214另一项研究报告牛磺酸改善了脆性X小鼠的学习能力(215).牛磺酸已在两项针对儿童和成人的开放标签治疗研究中进行研究,但未发现显著的持续益处(Level 2b)(216,217)而两项关于牛磺酸衍生物taltrimide的开放标签研究在一项研究中无临床效应,另一项研究(Level 2b)显示引发痉挛效应(218,219).因此,牛磺酸因可能对癫痫治疗产生不利影响而获得D至PD的总质量评级。牛磺酸对ASD和癫痫儿童的影响尚未有系统性研究,导致GOR为N。鉴于尚未发现它对癫痫儿童有效,支持其在自闭症谱系障碍和癫痫儿童中的使用几乎没有支持。 肉诺菘肉诺辛(B-丙烯酰-L-组氨酸)是一种天然存在的二肽,不仅是组氨酸的来源,组氨酸是组胺的前体(220,221但与组胺不同,它能够穿过血脑屏障。在一项为期8周的DBPC研究中,L-肉诺孕酮已被证明能显著改善Gilliam自闭症评分量表和接受单词图像词汇测试,且无不良反应(222).仅有一项2b级研究,l-肉诺碱在治疗ASD的认知和行为症状方面获得了C级的总质量评级。 多项研究已证实组胺参与调控癫痫易感性的机制(223–225).在动物癫痫发作模型中,局部引入组胺或组氨酸会提高癫痫阈值(Level 5)(224,226–228).在多种癫痫动物模型中,肉诺辛已被证明具有抗癫痫作用(Level 5)(228–231因此,基于实验台研究的证据获得了GOR D – BR评级。l-肉诺辛尚未在ASD和癫痫儿童中进行评估,因此其总质量为N。l-卡诺辛耐受性良好,有潜力改善ASD症状和癫痫发作,因此对ASD和癫痫患者来说可能是有前景的治疗。 欧米伽-3脂肪酸多项研究已证明,欧米伽-3脂肪酸,特别是二十二碳六烯酸,在癫痫动物模型中具有保护作用(232),激发了人们对人体使用这些药物的热情,尤其是因为它们对心血管健康的积极影响(233).一项早期DBPC研究(Level 1b)表明,欧米伽-3脂肪酸对癫痫发作的影响是短暂的(234而较新的小型开放标签(235)和DBPC(236研究(2b级)显示难治性癫痫患者发作率有改善趋势。然而,另一项DBPC研究(2b级)并未证实这一发现(237难治性癫痫。有趣的是,一项针对难治性癫痫患者的小型DBPC(2b级)研究显示心血管健康参数显著改善,尤其是在癫痫突发不明原因死亡指标方面有所改善(236另一项针对难治性癫痫患者的小型DBPC研究(Level 2b)使用磁共振光谱法,显示膜磷脂分解减少,脑内能量代谢改善(238).因此,欧米伽-3脂肪酸在癫痫治疗中获得的总质量为C。 多项研究指出,ASD患者中必需脂肪酸的含量异常(239–242).多项小型临床研究探讨了欧米伽-3脂肪酸对儿童和成人ASD的影响。两项开放标签研究(Level 2b)显示ASD症状有所改善(243,244而在其他开放标签(Level 2b)研究中,成人或儿童ASD中未发现显著效应(245,246).两项DBPC研究(Level 2b)显示多动行为改善无显著性(247,248)以及刻板印象的行为(247)在自闭症谱系障碍(ASD)个体中。因此,欧米伽-3脂肪酸在ASD中的使用证据依然有前景,导致OR为B。尚未在患有ASD和癫痫的儿童中评估欧米伽-3脂肪酸,因此其GOR为N。然而,它仍是一种有前景的新疗法。 同种疗法顺势疗法使用极稀释的活性药物溶液来刺激免疫防御并使稳态机制正常化。相比之下,西医方法使用高剂量药物直接攻击微生物或阻断系统性反应。顺势疗法被持怀疑态度,因为其主要成分被稀释,几乎不存在于物质存在中。例如,顺势疗法药物有时会被稀释超过阿伏伽德罗的极限,这使得该药物的分子溶液中的可能性很低。顺势疗法药物的分析显示,使用多种科学方法,包括紫外光谱、拉曼光谱和热力学,在定量和定性上均存在差异。249,250).这些数据被用来支持有争议的假说:顺势疗法药物制备中用于制造的“sccussion”通过生成具有生物活性的替代结构水域来增强溶液的生物活性(49,251).虽然早期的荟萃分析得出结论,顺势疗法的临床效应无法完全用安慰剂效应来解释(252,253),一项比较顺势疗法和西医安慰剂对照试验的荟萃分析表明,顺势疗法研究中发现的弱效应与安慰剂效应一致(254). 顺势疗法治疗注意力缺陷障碍的有效性证据已在一项随机DBPC交叉试验(Level 1b)中得到记录(255建议为自闭症儿童申请。尽管多份病例报告(4级)建议顺势疗法可能对癫痫治疗有帮助(256,257),所用顺势疗法化合物的不一致以及这些报告中顺势疗法治疗开始与癫痫缓解之间缺乏时间关系,限制了证据的有力性。此外,唯一的ASD顺势疗法研究报告了治疗后行为恶化(258).因此,癫痫的 GOR 评分为 N,因为现有病例报告质量过低无法得出具体结论;而 GOR 评分为 D – PD,可能对自闭症谱系障碍有害。由于尚未在ASD和癫痫患者中进行研究,其总质量(GOR)为N。因此,顺势疗法似乎不是一个有前景的癫痫治疗方法,且可能对自闭症谱系障碍有害。 节食许多ASD儿童接受多种饮食治疗,包括无麸质酪蛋白(GFCF)和排除饮食,如费因戈尔德饮食。每个问题将单独讨论。 全球性质脂肪酸饮食在自闭症谱系障碍(ASD)治疗中备受关注。一项为期24个月的两阶段随机单盲对照试验(Level 1b)支持了GFCF饮食(259),但一项相对简短(12周)的DBPC交叉治疗试验(1b级)针对GFCF饮食,尽管家长报告有效性,但未能显示客观疗效证据(260).在一项回顾性、对照调查(3b级)中,针对有胃肠症状、食物过敏和/或敏感症或严格遵守饮食的儿童,家长们将GFCF饮食评估为显著改善了自闭症行为、生理症状和社交行为,相较于无这些障碍或在实施时有多次违规的儿童(261).因此,针对ASD症状,GFCF饮食的GOR为B。 最近的病例报告(Level 4)显示,GFCF饮食与KD的结合显著改善了一名12岁ASD女孩的癫痫发作(44).在最近一项针对自闭症谱系障碍儿童癫痫治疗的病例对照调查(3b级)中,家长们将GFCF饮食评为对癫痫发作及其他症状有良好效果的治疗方法(见图)2) (10).GFCF饮食尚未在非ASD人群中评估过癫痫,尽管有报告指出麸质敏感性与颞叶癫痫的海马硬化有关(262).因此,针对癫痫发作,GFCF饮食对ASD患者为GCR为C,对无ASD患者为GOR N。GFCF饮食与癫痫发作之间有一个有趣的联系,即GFCF饮食是无牛奶饮食,而无牛奶饮食可以降低FRα自身抗体的血清滴度(参见叶酸代谢异常)。 费因戈尔德饮食排除了食物添加剂,因此被认为能降低大脑的兴奋性-抑制性平衡(263).一项最新的系统综述和荟萃分析表明,人工食用色素排除可能在注意力缺陷多动障碍(Level 1a)的治疗中起作用(264),从而支持费因戈尔德饮食在某些神经发育障碍中的作用。Feingold饮食通过单一受试者设计改善未报告为ASD(4级)儿童的癫痫发作(263但尚未对癫痫、癫痫或自闭症谱系障碍患者进行任何额外研究。因此,Feingold饮食在癫痫发作时获得D至SC的GOR值,对于有无癫痫发作的ASD个体,GOR为N。 显然,需要更多的受控临床试验来证明这些有前景的饮食干预领域的疗效。饮食干预是重要的研究领域,尤其是许多父母自行实施饮食干预,且缺乏客观证据为父母提供指导。 经颅磁刺激重复经颅磁刺激(rTMS)是一种非侵入性技术,用于调节皮层的电生理活动,具有研究、诊断和治疗自闭症谱系障碍(ASD)和癫痫发作的潜力3) (265).低频(“慢”)rTMS(频率范围为0.3至1赫兹)优先激活径向、双花束轴突及其他抑制性中间神经元元件,已被提出通过长期衰减和皮层活动抑制来发挥作用(266).研究表明,在ASD患者的背外侧前额叶皮层上施用慢速rTMS可能增强该皮层区域周围小柱的抑制作用(267,268).使用rTMS的理由基于研究表明ASD存在小柱病,导致皮层抑制功能不足(269,270).尽管rTMS从未被用于治疗ASD的癫痫发作或癫痫,但已有多项研究探讨其在ASD症状治疗和癫痫治疗中的应用。在ASD患者中,低频rTMS已被证明能改善错误监测(271),事件相关伽马 (267),以及重复性仪式行为(267)在两个小型开放标签对照试验(Level 2b)中进行,并在一个小型开放标签非对照试验(Level 2b)中改善与新颖刺激相关的事件相关电位(268).因此,它在治疗自闭症谱系障碍时获得了B级的总质量(GOR)。三项随机DPBC研究考察了低频rTMS治疗成人癫痫(2b级)的影响。虽然只有一项研究显示癫痫发作有显著减少(272另一项研究显示,癫痫发生率降低具有边缘显著性(273),而第三组则显示三分之一患者的癫痫样异常显著减少(274).在另一个较新的病例系列(4级)中,使用低频rTMS检测证实癫痫型分泌物减少(275).因此,该机构在癫痫治疗方面获得了B级的GCOR。由于慢速rTMS尚未在ASD和癫痫患者中进行研究,其GOR为N。显然,低频rTMS是治疗癫痫和ASD的有前景的新疗法,应进行更大规模的DPBC研究以进一步探讨其治疗效果。
[size=0.875]FIGURE 3
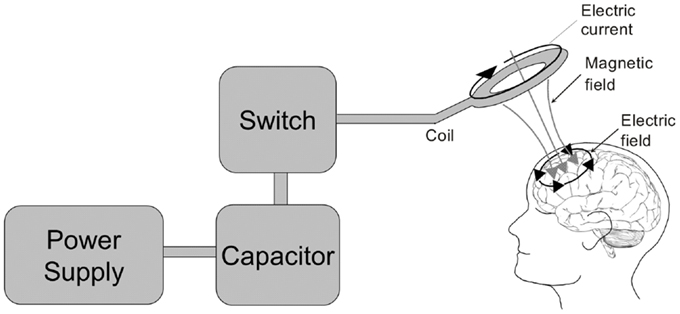 图3。经颅磁刺激器。左侧展示了经颅磁刺激电路的方框图。电源为电容充电。接着,操作员或计算机通过晶闸管开关发出信号,将电容器中储存的电荷释放到刺激线圈中。流经刺激线圈的电流(此处表现为圆形线圈)会产生垂直磁场,横穿颅骨,并在线圈下方的皮层内感应出电流。
总结本综述旨在概述传统和新颖治疗方法在ASD患者癫痫发作中的证据。使用标准化刻度,表格3提出证据支持使用这些治疗来改善整体癫痫发作,改善与ASD相关的行为和认知症状,并专门改善ASD个体的癫痫发作。本综述最明显的结论之一是,针对自闭症谱系障碍(ASD)个体的癫痫治疗方法很少被专门评估。特定遗传(93)、代谢(276)、以及免疫学(276)异常以及皮层过度兴奋性(277)被认为与自闭症谱系障碍(ASD)有关。所有这些异常也可能促使ASD患者发生癫痫和癫痫。因此,确定针对这些病理生理机制的特定治疗是否有效非常重要,因为这些治疗可能改善癫痫发作,同时改善或至少加重自闭症谱系障碍的核心症状。 自闭症谱系障碍癫痫发作的抗癫痫药物治疗尽管近十年前已有相关问题被指出,但目前尚无严格控制的临床试验来评估AED在治疗ASD患者癫痫发作中的有效性或疗效(278).有充分理由相信某些AED可能更适合某些ASD患者。AED可能引起神经系统不良反应(如共济失调、震颤和眼球震颤)、胃肠道不良反应(如腹痛和恶心)以及过敏反应。由于AED在发育障碍儿童中副作用较为常见,副作用风险较高的AED可能限制其在治疗ASD儿童中的效用(279).此外,长期使用AED,尤其是较老的AED治疗,可能导致记忆和/或注意力缺陷,以及嗜睡、精神运动异常和头晕(280).另外,ASD也可能与皮层过度兴奋性相关,可能是由于皮层抑制回路缺陷或谷氨酸受体异常所致(277,281,282).因此,增强γ胺基丁酸(GABA)信号的抗癫痫药,如丙戊酸、加巴喷丁、氯巴占、氯硝西泮、苯巴比妥、普米酮、替咪宾或维加巴特林,可能是ASD患者相对更好的治疗方法。最后,由于ASD患者发作类型广泛,广谱抗癫痫药如丙戊酸、拉莫三嗪或左乙拉西坦可能是最佳治疗。 从上述文献综述来看,目前仅有有限证据指导选择特定抗癫痫药治疗ASD癫痫发作,尽管这些有限证据在各研究中似乎是一致的。大多数关于自闭症谱系障碍(ASD)抗母药的研究主要报告了三种抗癫痫药的数据:丙戊酸、拉莫三嗪和左乙拉西坦。一些研究还报告了苯妥英、卡马西平、乙琥胺、托吡酯、奥卡西平、加巴喷丁和苯巴比妥在ASD患者中的应用。总体来看,研究表明广谱抗癫痫药,特别是丙戊酸、拉莫三嗪和左甲拉西坦,效果最为显著,且认知和神经不良反应率较低。因此,这些可能是ASD和临床癫痫患者最合适的初级抗癫痫药物。我们将在下面简要介绍这些AED。 丙戊酸是一种广谱抗癫痫药,已在多项DBPC研究中被证实具有积极的行为效应,病例报告和开放标签试验中与核心ASD症状的改善相关,且在治疗剂量下对认知几乎没有不良影响(283).然而,它需要多次血液检查,可能消耗肉碱,并可能导致严重的不良反应,包括肝毒性、高氨血症和胰腺炎。L-肉碱已被证明能减轻甲戊酸诱发性脑病患者的高氨血症,推荐用于严重的丙戊酸中毒患者。高风险儿科患者建议与左旋肉碱联合治疗(284,285).鉴于ASD儿童线粒体功能障碍的风险较高,且整体肉碱水平较低(107,286),肉碱缺乏可能是发生丙戊酸肝毒性的风险因素(287,288),在给ASD患者开立丙戊酸时,尤其是摄入少量牛肉或猪肉(肉碱的主要饮食来源)时,建议开始L-肉碱补充剂。推荐口服剂量在每天30至100毫克/公斤之间,分两到三次分组服用,适用于高风险人群,如幼儿或肉碱缺乏者(284).因此,在给ASD儿童开具丙戊酸时,最好谨慎并监测治疗期间的肉碱水平。然而,许多针对ASD人群的研究报告称丙戊酸耐受良好且显著有益,这令人感到安心。 拉莫三嗪是另一种广谱抗癫痫药,被认为对癫痫患者的认知影响极小(36)并可能对核心ASD症状有积极影响(17),或者至少不会加重行为或自闭症(35).拉莫三嗪作为一线抗癫痫药的使用需要与治疗剂量的延长时间进行平衡,以最大限度减少史蒂文斯-约翰逊反应可能出现的严重不良反应。 左甲拉西坦是一种相对广谱的抗癫狂药,肝脏代谢极低,严重不良反应发生率低。左乙拉西坦在普通人群中最常见的不良反应是行为方面,包括躁动、攻击性行为和情绪不稳定。然而,令人欣慰的是,DBPC试验显示接受左乙拉西坦治疗的ASD儿童在异常、重复行为、冲动或多动方面没有变化(34).如果出现行为不良反应,可以用吡哆醇缓解。Major 等人 (289患者服用左甲拉西坦平均剂量63 mg/kg/天,若开始服用左甲拉西坦后出现行为问题,则平均服用6 mg/kg/天吡哆醇。在22名接受治疗的患者中,41%改善,36%无变化,18%恶化。一项病例研究还报告了吡哆醇治疗下左甲拉西坦相关行为异常的改善(290).由于吡哆醇显然并非在所有病例中有效,且左甲拉西坦在对照研究中似乎未对自闭症谱系障碍造成显著行为问题(34),最好按需使用吡哆醇。还需注意,许多ASD儿童可能已经在服用一种吡哆醇作为新疗法(10).此外,本综述建议吡哆醇与Mg联合使用可能比单独使用更适合自闭症儿童的行为,因此将Mg加入吡哆醇治疗可能是明智的。左甲拉西坦有静脉注射和液体制剂,因此可以快速调整剂量,提供给无法口服药物的人群,也适合无法吞服药丸的儿童。 线粒体疾病和功能障碍在ASD患者中较为常见(106,107,276,286),某些抗癫痫药可能更适合线粒体异常患者。有人担心在自闭症谱系障碍中使用丙戊酸,因为它对特定多重病儿童可能造成毁灭性影响。需要理解的是,这种有害影响仅限于患有POLG1突变和患有肌阵挛性癫痫并伴有参差红纤维综合征的人群(291).POLG1突变仅在两名ASD儿童中报告,约占有多重心病的ASD儿童的2%,迄今尚未在ASD患者中报告出现带有参差红色纤维的肌阵挛性癫痫(107).鉴于约5%的ASD儿童具有经典定义的MD,因此POLG1突变的估计患病率约为ASD人群的0.1%。一项研究考察了常见的抗癫痫药(如苯巴比妥、卡马西平和拉莫三嗪)对线粒体功能的影响。虽然卡马西平对线粒体功能长期使用有害,拉莫三嗪则能增强线粒体功能(292).其他体外研究也证明拉莫三嗪具有线粒体保护作用(293).因此,目前缺乏证据指导针对有无ASD的线粒体异常儿童的最佳抗癫痫药治疗。然而,鉴于拉莫三嗪在ASD患者中耐受良好,且可能对线粒体功能有积极影响,至少在初步研究中,拉莫三嗪可能是ASD和MD儿童的最佳抗癫痫药。这确实是一个适合临床研究的领域。 总体而言,上述数据支持将丙戊酸盐、拉莫三嗪和左乙拉西坦作为患有癫痫或癫痫儿童的ASD儿童的首选治疗。桌子4列出了一些可能有助于选择一线AED的指导原则。显然,需要更多研究来证明抗癫痫药在自闭症谱系障碍人群中的疗效。
[size=0.875]TABLE 4
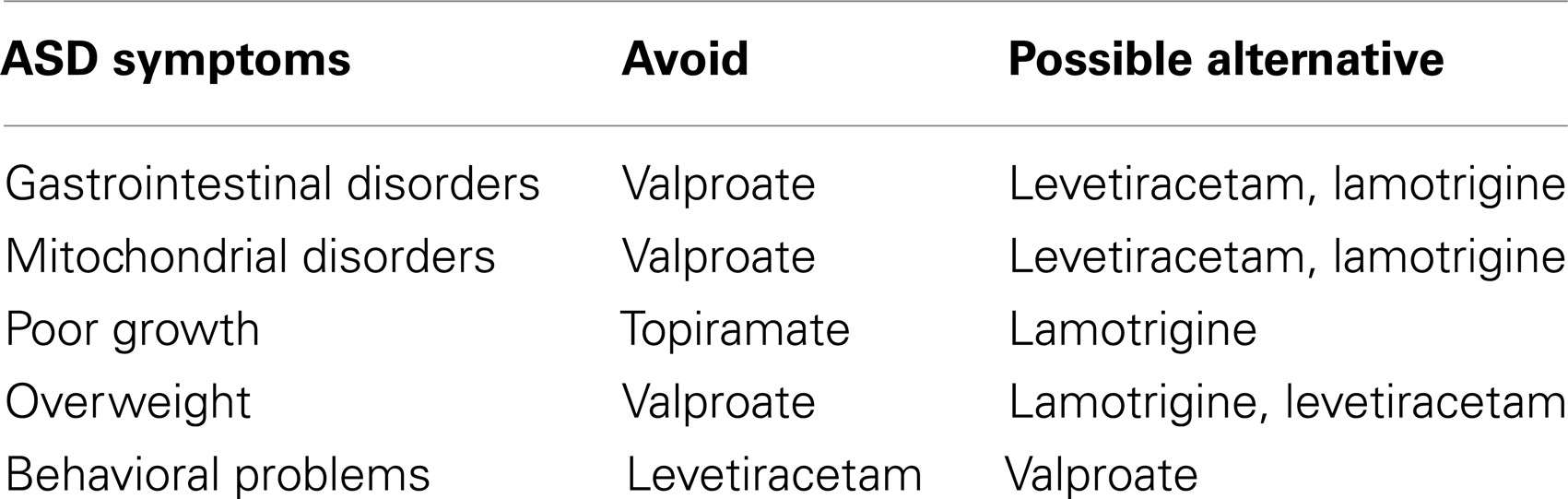 表4。为自闭症谱系障碍儿童选择一线抗癫痫药物的指南。
传统非抗癫痫药物治疗自闭症谱系障碍癫痫回顾了几种传统非AED治疗癫痫发作的方法,特别是KD和MAD、VNS、标准癫痫手术和MST、免疫调节疗法以及神经反馈。总体而言,除标准癫痫治疗(如皮层切除)和VNS外,许多此类疗法在治疗ASD儿童癫痫方面具有前景。 KD和MAD可能有助于治疗ASD的多个方面,尤其是患有癫痫发作和/或MD的ASD患者。事实上,最近人们对在自闭症谱系障碍中使用这些饮食的兴趣有所增加(294–297).KD可能是治疗多重症的有效方法(298–300)并被推荐用于共病多重症和癫痫患者(301).鉴于ASD患者和共病MD患者癫痫发作率较高(107),KD和MAD应被强烈纳入ASD和共病MD个体亚组。此外,鉴于KD和MAD的优异安全性,以及研究显示其在耐药性癫痫中的疗效和ASD耐受性,应考虑KD和MAD治疗对标准治疗无效癫痫的ASD儿童。当然,儿童在开始KD时应密切监测,因为该饮食可能加重与线粒体或其他代谢疾病相关的代谢性酸中毒,应由有经验的从业者管理。 虽然标准癫痫手术可能有助于控制癫痫发作,但目前尚无充分证据支持标准癫痫手术能改善认知能力或ASD相关症状,且许多案例中标准癫痫手术反而加重了这些因素。多个病例系列表明MST可能改善癫痫发作和ASD相关症状。一项研究显示了显著效果,儿童接受了广泛的电生理学检查,并用MST进行了细致的手术治疗焦点。然而,MST需要更广泛的研究,才能将其作为难治性癫痫儿童的常规治疗选择。 鉴于关于自闭症谱系障碍免疫失调的文献日益增多(276免疫调节治疗对患有自闭症谱系障碍和癫痫的儿童有效也不足为奇。有一些有前景的研究表明,IVIG和类固醇在治疗癫痫、ASD相关症状和癫痫方面均有前景,尽管这些研究质量均不高。鉴于这些治疗针对特定的病理生理机制,制定明确的指导方针,识别可能受益于此类治疗的ASD儿童(无论有无癫痫),尤其是考虑到长期使用免疫调节疗法(如类固醇)可能带来的不良反应。显然,这是一个值得进一步临床研究的领域。 神经反馈是一种针对癫痫发作和自闭症谱系障碍症状的新兴治疗方法,具有优异的安全性,且其有效性的证据日益增强。然而,研究仅限于能够配合治疗方案的特定个体,且在非常年幼的儿童和成人、功能较低的人群以及ASD症状较重的人群中代表性不足。由于神经反馈的安全性,这对自闭症儿童来说可能是有前景的治疗方法,但更多的盲法研究将进一步加强该疗法的有效性和疗效证据。 因此,若干非AED传统疗法在治疗ASD患者癫痫发作方面展现出相当大的前景,包括低碳水化合物饮食如KD和MAD、MST、免疫调节疗法和神经反馈,尽管在这些领域仍需更多研究以获得更充分的证据,以确定这些疗法的疗效和有效性,以及哪些特定ASD亚组对这些疗法反应最好。标准癫痫手术治疗增加了加重ASD症状的风险,且多项研究显示VNS未显示能改善ASD症状。因此,后两种疗法可能应保留用于对其他癫痫治疗无效的癫痫。 与自闭症谱系障碍相关的遗传和代谢综合征癫痫的治疗方法本综述考察了针对ASD和癫痫相关的特定综合征的治疗方法,包括遗传综合征如TSC和Fragile X,以及代谢障碍如线粒体疾病和功能障碍、尿素循环障碍、琥珀酸半醛脱氢酶、分支链酮酸脱氢酶激酶、肌酸和生物素酶缺乏、史密斯-莱姆利-奥皮茨综合征、吡哆醇依赖性及反应性癫痫、有机酸血症以及叶酸和钴胺代谢异常。 线粒体疾病以及脑叶酸代谢功能障碍和异常是两种与癫痫相关的代谢异常,似乎影响了相当一部分ASD患者。在对照研究中,针对这两种疾病的多种治疗方法已证明在治疗ASD相关症状方面有效,特别是左旋肉碱、含抗氧化剂的多种维生素、N-乙酰-左半胱氨酸和叶林酸。在非对照研究中,氟琳酸还被证明能改善癫痫发作和脑叶酸异常患者的癫痫发作。因此,这些治疗对部分ASD和癫痫患者非常有用,应在特定病例中予以重视。 也有证据表明ASD中钴胺相关代谢存在缺陷,但钴胺素缺乏本身并未被证实。尽管如此,目前有限证据表明甲钴胺能改善ASD症状和谷胱甘肽代谢,且其他证据表明钴胺补充剂对钴胺素缺乏引起的癫痫发作有帮助。由于甲钴胺素对ASD患者可能具有潜在帮助,因此该治疗对ASD和癫痫患者可能有效,但在做出此类建议前仍需进一步研究。 多个案例研究表明,ASD可能出现在特定的代谢综合征中,这些综合征需要特定治疗。在有限的研究中,针对该综合征的背景下,针对肌酸缺乏、D-甘油尿症和吡哆醇依赖且有反应性癫痫的治疗似乎有助于治疗癫痫发作,而肌酸缺乏、D-甘油酸尿症和尿素循环障碍的治疗则似乎有助于治疗ASD相关症状。针对生物素酶缺乏症、分支链酮酸脱氢酶激酶缺乏症和半醛脱氢酶缺乏症的治疗,似乎对ASD患者的ASD症状或癫痫发作无益,但这基于有限的报告。 对于被审查的两种遗传综合征,目前尚无经过临床验证的治疗方法能够解决其潜在的病理生理机制,尽管实验室研究仍在积极进行中。对于TSC,维加巴特林是婴儿痉挛和癫痫发作的首选抗癫痫药,且在生命早期开始时效果最佳。对于脆弱X,标准的抗癫痫药治疗目前似乎是主要手段。希望正在进行的临床试验能为解决这些综合征潜在病理生理的新颖有效疗法提供证据。 本综述为针对特定综合征的ASD癫痫治疗提供了指导,并建议某些新疗法,包括L-肉碱、含抗氧化剂的多种维生素、N-乙酰-l-半胱氨酸和叶林酸,可能对更广泛的ASD和癫痫患者有帮助。 自闭症谱系障碍癫痫发作的潜在新疗法本综述探讨了可能对自闭症谱系障碍和癫痫患者有用的新疗法。这些新疗法包括镁、吡哆醇和联合mg、锌、DMG、牛磺酸、左旋肉诺辛、欧米伽-3脂肪酸、顺势疗法、GFCF和Feingold/排除饮食,以及低频重复经颅磁刺激。 镁作为癫痫的辅助疗法有充分证据,但缺乏证据支持其用于自闭症谱系障碍相关症状。然而,有证据表明镁与吡哆醇联合使用可以改善ASD相关症状。由于吡哆醇和镁单独使用似乎对ASD相关症状无害,且吡哆醇本身可以治疗潜在代谢缺陷,镁和吡哆醇联合用于治疗ASD和癫痫患者可能是值得研究的良好治疗方法。作为ASD和癫痫患者的辅助治疗,Mg是一个不错的选择,尤其是因为它还能治疗便秘,便秘是ASD患者中常见的症状,尤其是线粒体异常患者。 欧米伽-3脂肪酸在癫痫和自闭症谱系障碍(ASD)中的应用引起了广泛关注。初步报告令人鼓舞,但显然影响较为微妙,需要更大样本的临床样本才能在临床研究中获得统计学显著性。该补充剂的一个有趣方面是其对癫痫患者的心血管潜在益处,特别是改善癫痫突发原因不明死亡的指数。这尤为重要,因为ASD和癫痫患者似乎比无癫痫的ASD患者有更高的无法解释死亡率(302). GFCF饮食对部分ASD儿童似乎有效,并在一项针对ASD患者癫痫患者的对照调查中被评为改善癫痫发作的效果。有趣的是,最近的一项病例报告表明,将GFCF饮食与KD结合使用可能在自闭症谱系障碍难治性癫痫中具有一定效用。GFCF饮食也是一种无奶饮食,可以降低叶酸受体α自身抗体。因此,GFCF饮食在能够实施的家庭中可能对控制癫痫发作有一定效用,尽管显然需要受控研究来确定这一可能性。 L-肉诺孕素在治疗自闭症谱系障碍相关症状方面有证据支持,实验室研究表明肉诺辛及其活性代谢物在癫痫动物模型中可能具有治疗效果。因此,l-卡诺辛可能是一种新颖的治疗方法,在治疗ASD患者的癫痫发作中具有应用价值。此外,实验室研究显示锌能调节神经兴奋性,临床研究也发现锌在癫痫患者中异常。鉴于ASD患者中已描述锌异常,这可能是针对ASD和癫痫患者的一种新疗法。 经颅磁刺激是一种新兴治疗方法,在有限的研究中已显示出对癫痫发作和ASD症状的有效性,且在儿童中似乎安全。尽管该治疗需要相对配合的患者,因此限制了适用的特定ASD患者,但它可能对部分难治性癫痫患者有益。显然,更多研究和高质量临床试验将有助于进一步探讨该疗法。 某些治疗方法,如牛磺酸和顺势疗法,至少基于有限证据可能有害,因此建议应一般避免在ASD和癫痫患者中使用。在有限的研究中,DMG似乎对治疗癫痫或ASD症状无效,因此通常对ASD癫痫的治疗无效。 因此,本综述表明,某些新疗法,如Mg与吡哆醇、Omega-3脂肪酸、GFCF饮食法以及低频重复经颅磁模拟,可能对治疗癫痫和ASD症状有益,而其他治疗如锌和左旋肉诺酸也具有一定潜力。其他治疗方法如牛磺酸、DMG和顺势疗法可能不太实用。 既往研究的局限性及未来研究指南许多被回顾的研究存在重大局限,尤其是在记录治疗效果、定义自闭症谱系障碍(ASD)以及癫痫和ASD症状改善后的方法上。很少有高质量、对照和/或盲法的研究,即使是高质量研究的样本也相对较小,限制了研究结果的普遍适用性。许多研究没有明确的人群,也未使用标准化工具,如自闭症诊断观察表或自闭症诊断访谈——修订版以记录自闭症谱系障碍的诊断,语言和智力发展等重要因素在大多数研究中也未被明确定义。此外,许多研究并未定量测量癫痫发生的变化,且使用多种标准来定义癫痫的改善。长期研究也非常需要,因为许多治疗方法需要使用数年甚至数十年,而大多数临床研究通常持续数月,且部分药物可能存在长期不良反应。因此,未来必须通过高质量的DBPC研究评估有前景的自闭症患者癫痫发作治疗方法,以确立疗效并实施长期随访。 结论:治疗患有自闭症谱系障碍儿童癫痫发作的方法目前尚无针对自闭症谱系障碍患者癫痫发作治疗的指导方针。癫痫发作可以通过多种方法治疗。确定癫痫发作的潜在医学病因将有助于指导具体治疗方案。许多ASD和癫痫患者可能表现出线粒体疾病、功能障碍或脑叶酸异常。识别和治疗这些潜在异常可以为患者带来显著益处,并改善癫痫发作。对于没有特定治疗方法或无法确定病因的病因,似乎有特定的抗癫痫药(AED)作为一线治疗最有前景,如拉莫三嗪、丙戊酸和左白拉西坦。当然,患者特征应指导抗体抗癫痫药的选择以及辅助治疗,以最大限度减少不良反应。有前景的非抗癫痫药治疗方法,如KD和MAD,对患有癫痫的ASD患者尤其有效。一些新颖的治疗方法,如Mg,理论上可以作为辅助治疗来帮助治疗癫痫发作,但需要严格的研究,才能被考虑用于儿童ASD癫痫的普遍治疗。 作者贡献该手稿的部分内容是在2009年和2010年芝加哥AutismOne会议以及2009年10月加拿大多伦多举办的AutismOne加拿大会议上,Elias Tembenis癫痫智库期间开发的。这些智库包括在自闭症谱系障碍(ASD)相关癫痫发作方面有专业知识的科学家和临床医生。参与者来自治疗自闭症谱系障碍的各类研究人员和从业者。2009年5月最初智库的参与者为本稿中的信息内容提供了基础。以下两个智库(2009年10月和2010年5月)的个人为该文件提出了建议。为补充部分提供书面文本或参与编辑的个人参与者被认定为作者。法特米博士的研究员协助写作,但未参加智库会议。 利益冲突声明作者声明,该研究是在没有任何可能被解释为潜在利益冲突的商业或财务关系的情况下进行的。 缩写5MTHF,5-甲基四氢叶酸;抗癫痫药(AED);AER,自闭症癫痫样退化;自闭症谱系障碍(ASD);BR,实验研究;钙,钙;DBPC,双盲安慰剂对照 D,可能有害;DMG,二甲基甘氨酸;脑电图,脑电图;FRα,叶酸受体α;GABA,γ-氨基丁酸;GFCF,无麸质酪蛋白;推荐等级(GOR);HEADD、肌张力低下、癫痫、自闭症和发育迟缓;静脉注射免疫球蛋白(IVIG);KD,生酮饮食;MAD,改良阿特金斯饮食;MD,线粒体疾病;MEG,脑磁图;Mg,镁;硫酸镁4,硫酸镁;MST,多处皮下切开;N,没有研究;NE,中性效果;rTMS,重复经颅磁刺激;SC,单案报告或系列;结节性硬化综合症TSC;迷走神经刺激器VNS;锌、锌。 D,可能有害;DMG,二甲基甘氨酸;脑电图,脑电图;FRα,叶酸受体α;GABA,γ-氨基丁酸;GFCF,无麸质酪蛋白;推荐等级(GOR);HEADD、肌张力低下、癫痫、自闭症和发育迟缓;静脉注射免疫球蛋白(IVIG);KD,生酮饮食;MAD,改良阿特金斯饮食;MD,线粒体疾病;MEG,脑磁图;Mg,镁;硫酸镁4,硫酸镁;MST,多处皮下切开;N,没有研究;NE,中性效果;rTMS,重复经颅磁刺激;SC,单案报告或系列;结节性硬化综合症TSC;迷走神经刺激器VNS;锌、锌。 引用1. 戴金·艾,麦克马洪·B。自闭症儿童癫痫发作的发生率。《美国精神病学杂志》(1979年)136:1310–2。
2. 沃尔克马尔 FR,尼尔森DS。自闭症中的癫痫障碍。《美国学术儿童青少年精神病学杂志》(1990年)29:127–9。doi:10.1097/00004583-199001000-00020
3. Tuchman R, Rapin I. 《自闭症中的癫痫》。《柳叶刀神经》(2002)1:352–8。doi:10.1016/S1474-4422(02)00160-6
4. Danielsson S, Gillberg IC, Billstedt E, Gillberg C, Olsson I. 自闭症青年癫痫:一项针对120名儿童诊断个体的前瞻性基于人群的随访研究。癫痫(2005)46:918–23。doi:10.1111/j.1528-1167.2005.57504.x
5. Hara H. 自闭症与癫痫:一项回顾性随访研究。《脑开发》(2007):29:486–90。doi:10.1016/J.BrainDev.2006.12.012
6. 维斯奇迪·外锋,特里切·外野手,佩斯科索利多中场,麦克林RL,约瑟夫·RM,斯宾塞·SJ,等人。自闭症谱系障碍儿童与共病癫痫的临床特征。PLoS One (2013) 8:e67797。doi:10.1371/journal.pone.0067797
7. 桑莎·G、卡尔森·C、多伊尔·W、韦纳·HL、布鲁夫斯坦·J、巴尔·W等。自闭症中的医学难治性癫痫。癫痫(2011)52:1071–5。doi:10.1111/j.1528-1167.2011.03069.x
8. 吉尔比·KL,奥布莱恩,TJ。癫痫、自闭症与神经发育:点燃共同的脆弱感?癫痫行为(2013)26:370–4。doi:10.1016/j.yebeh.2012.11.002
9. Tuchman R. 癫痫中的自闭症与社会认知:对综合癫痫护理的启示。Curr Opin Neurol(2013)26:214–8。doi:10.1097/WCO.0b013e32835ee64f
10. 弗莱 右边锋,斯里尼瓦苏拉 S,亚当斯 JB。自闭症谱系障碍伴癫痫的传统与非传统治疗方法:一项在线调查。BMC儿科(2011)11:37。数据来源:10.1186/1471-2431-11-37
11. 罗西尼奥尔地区检察官。自闭症谱系障碍的新颖与新兴治疗方法:系统综述。《安·克林精神病学》(2009年)21:213–36。
12. 理查森·威尔逊·威尔逊·威廉·威尔逊,西川·杰,海沃德·雷斯·构建良好的临床问题:循证决策的关键。ACP J 俱乐部(1995)123:A12–3。
13. 弗莱 RE、卡萨诺瓦·M、布朗·GL、马丁·V、埃德尔森·S、莱因·J 等。这是伊莱亚斯·坦贝尼斯查获智库的共识声明。《自闭症科学文摘》(2012年)1:5–10。
15. Aman MG, van Bourgondien ME, Wolford PL, Sarphare G. 自闭症受试者的精神药物和抗癫痫药物:患病率及使用模式。《美国学术杂志儿童青少年精神病学》(1995)34:1672–81。DOI:10.1097/00004583-199512000-00018
16. 吉尔伯格 C.自闭症中癫痫的治疗。《自闭症发展杂志》(1991)21:61–77。doi:10.1007/BF02206998
17. 乌夫布兰特·P,鲍齐恩·R. 儿童难治性癫痫。拉莫三嗪治疗的疗效,包括非癫痫相关益处。《神经儿科学》(1994)25:284–289。DOI:10.1055/S-2008-1073041
18. 小本 J, Usui S, Hirata, J. 婴儿自闭症与情感障碍。《自闭症发展杂志》(1984)14:81–4。doi:10.1007/BF02408557
19. Deonna T, Ziegler AL, Moura-Serra J, Innocenti G. 自闭症倒退与边缘系统病理和癫痫的关系:两例报告。Dev Med Child Neurol(1993)35:166–76。doi:10.1111/J.1469-8749.1993.TB11619.x
20. Rittey CD。案件摘要:本杰明。《夺取》(1994)3(补充A):25–27。
21. 格劳泽·T,本-梅纳赫姆·E,布尔乔亚·B,克南·A,格雷罗·C,卡尔维亚宁·R等。更新的ILEE证据综述,关于抗癫痫药物作为癫痫发作和综合征初次单用治疗的疗效和有效性。癫痫(2013)54:551–63。doi:10.1111/epi.12074
22. Hollander E, Soorya L, Wasserman S, Esposito K, Chaplin W, Anagnostou E. Divalproex 钠与安慰剂在自闭症谱系障碍重复行为治疗中的比较。《国际神经精神药学杂志》(2006)9:209–213。doi:10.1017/S1461145705005791
23. Anagnostou E、Esposito K、Soorya L、Chaplin W、Wasserman S、Hollander E. Divalproex 与安慰剂在预防自闭症谱系障碍中氟西汀治疗相关的易怒反应。《临床精神药学杂志》(2006)26:444–446。doi:10.1097/01.jcp.0000227703.72117.bc
24. 霍兰德·E、查普林·W、苏里亚·L、沃瑟曼·S、诺沃特尼·S、鲁索夫·J等。地伐普洛钠与安慰剂在治疗自闭症谱系障碍儿童和青少年易怒方面的比较。神经精神药理学(2010)35:990–998。doi:10.1038/NPP.2009.202
25. 赫林斯 JA,韦克鲍 M,尼克尔 EJ,凯恩 SE,扎科内 JR,里斯 RM 等。一项双盲、安慰剂对照研究,针对患有广泛性发育障碍青少年的缬戊酸攻击性。《儿童青少年精神药学杂志》(2005)15:682–92。DOI:10.1089/cap.2005.15.682
26. 霍兰德 E,多尔戈夫-卡斯帕 R,卡特赖特 C,拉维特 R,诺沃特尼 S.自闭症谱系障碍中二丙戊钠的公开试验。《临床精神病学杂志》(2001年)62:530–4。doi:10.4088/JCP.v62n07a05
27. Gillberg C, Schaumann H. 癫痫表现为婴儿自闭症?两个案例研究。《神经儿科学》(1983年)14:206–212。DOI:10.1055/S-2008-1059580
28. 苏夫纳·R.在治疗患有典型和非典型双相情感障碍的智障患者中的使用。《临床精神病学杂志》(1989)50(增刊):40–43。
29. Nass R, Petrucha D. 获得性失语症伴抽搐障碍:一种广泛性发育障碍变异。《儿童神经杂志》(1990年)5:327–328。doi:10.1177/088307389000500411
30. Plioplys AV. 自闭症:脑电图异常及用丙戊酸临床改善。《青少年医学小学》(1994)148:220–22。doi:10.1001/archpedi.1994.02170020106021
31. 查尔兹 JA,布莱尔 JL。自闭症双胞胎癫痫的丙酸治疗。神经科学杂志 Nurs(1997) 29:244–8。doi:10.1097/01376517-199708000-00005
32. Damore J, Stine J, Brody L. 阿斯伯格症中的药物诱导轻躁狂。《美国学术儿童青少年精神病学杂志》(1998)37:248–9。doi:10.1097/00004583-199803000-00006
33. 鲁吉诺 TA,萨姆索克 TC。自闭症儿童中的左甲拉西坦:一项开放标签研究。《儿童行为杂志》(2002)23:225–30。doi:10.1097/00004703-200208000-00006
34. Wasserman S, Iyengar R, Chaplin WF, Watner D, Waldoks SE, Anagnostou E 等儿童和青少年自闭症中左甲西拉西坦与安慰剂:一项双盲安慰剂对照研究。国际临床精神药学杂志(2006) 21:363–7。doi:10.1097/01.yic.0000224787.13782.0f
35. Belsito KM,Law PA,Kirk KS,Landa RJ,Zimmerman AW。拉莫三嗪治疗自闭症障碍:一项随机、双盲、安慰剂对照试验。《自闭症发展杂志》(2001)31:175–81。doi:10.1023/A:1010799115457
36. Placidi F、Marciani MG、Diomedi M、Scalise A、Pauri F、Giacomini P 等。拉莫三嗪对局灶性癫痫夜间睡眠、白天嗜睡及认知功能的影响。Acta Neurol Scand (2000) 102:81–6。doi:10.1034/j.1600-0404.2000.102002081.x
37. Vajda FJ、Dodd S、Horgan D. 拉莫三嗪在癫痫、妊娠和精神病学中的应用——适合四季的药物吗?《临床神经科学杂志》(2013)20:13–6。DOI:10.1016/J.Jocn.2012.05.024
38. 雷扎伊·V、穆罕默迪·MR、加尼扎德·A、萨赫拉扬·A、塔布里齐·M、雷扎扎德·SA等。利培酮加托吡酯在自闭症儿童中的双盲安慰剂对照试验。《神经精神药学进步生物学精神病学》(2010年)34:1269–72。doi:10.1016/j.PNPBP.2010.07.005
39. Canitano R. 临床使用托吡酯以对抗神经阻滞剂引起的体重增加,涉及10名自闭症谱系障碍患者。《脑开发》(2005)27:228–32。doi:10.1016/j.braindev.2004.06.006
40. 布茨马·HP,奥尔登坎普·AP,迪普曼·L,胡尔斯曼·J,兰布雷希特·D,莱嫩·L,等。抗癫痫药物对认知的影响:患者在临床实践中对托吡酯与左甲拉西坦的认知问题感知。癫痫(2006)47(Suppl 2):24–7。doi:10.1111/j.1528-1167.2006.00683.x
41. Levy RG、Cooper PN、Giri P. 生酮饮食及其他癫痫饮食治疗。Cochrane数据库系统评论(2012)3:CD001903。
42. Miranda MJ, Mortensen M, Povlsen JH, Nielsen H, Benniczky S. Danish关于儿童医学难治性癫痫改良型阿特金斯饮食的研究:我们能否实现与经典生酮饮食相同的效果?《夺取》(2011)20:151–5。doi:10.1016/j.seizure.2010.11.010
43. 埃万杰里乌·A、弗拉霍尼科利斯一世、米哈伊利杜·H、斯皮利奥蒂·M、斯卡尔帕莱祖·A、马卡罗纳斯·N等。生酮饮食在自闭症行为儿童中的应用:初步研究。《儿童神经杂志》(2003年)18:113–118。doi:10.1177/08830738030180020501
44. 赫伯特·巴克利 法官自闭症与饮食治疗:病例报告与文献综述。《儿童神经杂志》(2013)28:975–82。DOI:10.1177/0883073813488668
45. Fisher RS, Handforth A. 《再评估:癫痫迷走神经刺激:美国神经学会治疗与技术评估小组报告》。神经学(1999年)53:666–669。doi:10.1212/WNL.53.4.666
46. 公园教育局。迷走神经刺激疗法对难治性癫痫患者及兰道-克莱夫纳综合征或自闭症患者的影响。癫痫行为(2003)4:286–90。doi:10.1016/S1525-5050(03)00080-5
47. Warwick TC、Griffith J、Reyes B、Legesse B、Evans M. 迷走神经刺激对颞叶癫痫和阿斯伯格综合征患者的影响:病例报告与文献综述。癫痫行为(2007)10:344–347。doi:10.1016/j.yebeh.2007.01.001
48. Danielsson S, Viggedal G, Gillberg C, Olsson I. 迷走神经刺激对8名自闭症谱系障碍儿科患者耐药性癫痫无效:一项前瞻性2年随访研究。癫痫行为(2008)12:298–304。doi:10.1016/j.yebeh.2007.10.007
49. 米尔格罗姆·L.顺势疗法可能吗?《健康促进杂志》(2006)126:211–8。doi:10.1177/1466424006068237
50. Hoon AH Jr.,阿拉巴马州赖斯近颞叶与自闭症:病例报告与综述。Dev Med Child Neurol(1992)34:252–9。DOI:10.1111/J.1469-8749.1992.TB14999.x
51. 泰勒·DC,内维尔·BG,克罗斯·JH。儿童癫痫手术候选人中的自闭症谱系障碍。《欧洲儿童青少年精神病学》(1999年)8:189–92。doi:10.1007/s007870050128
52. Connolly MB, Hendson G, Steinbok P. 结节性硬化症综合症:癫痫管理综述,重点关注外科方面。查尔兹神经系统(2006)22:896–908。DOI:10.1007/S00381-006-0130-7
53. Tellez-Zenteno JF, Hernandez Ronquillo L, Moien-Afshari F, Wiebe S. 病灶性及非病灶性癫痫的手术结局:系统综述与荟萃分析。癫痫研究(2010)89:310–8。doi:10.1016/j.eplepsyres.2010.02.007
54. Szabo CA,Wyllie E,Dolske M,斯坦福 LD,Kotagal P,Comair YG。广泛性发育障碍儿童的癫痫手术。Pediatr Neurol (1999) 20:349–53。doi:10.1016/S0887-8994(99)00003-X
55. Gillberg C, Uvebrant P, Carlsson G, Hedstrom A, Silfvenius H. 两名青春期前男孩的自闭症与癫痫(以及结节性硬化?):癫痫手术前后的神经精神病学方面。智力障碍杂志 (1996) 40(Pt 1):75–81。doi:10.1111/j.1365-2788.1996.tb00606.x
56. 丹尼尔森 S,维格达尔 G,斯特芬堡 S,赖登哈格 B,吉尔伯格 C,奥尔森 I。《耐药性癫痫儿童癫痫手术前后精神病理学、心理社会功能与智商》。癫痫行为 (2009) 14:330–7。doi:10.1016/j.yebeh.2008.10.023
57. 麦克莱伦A、戴维斯S、海曼I、哈丁B、哈克尼斯W、泰勒D等。癫痫儿童颞叶切除术前后精神病理学。Dev Med Child Neurol(2005)47:666–72。doi:10.1111/j.1469-8749.2005.tb01051.x
58. Danielsson S, Rydenhag B, Uvebrant P, Nordborg C, Olsson I. 癫痫儿童颞叶切除术:神经精神病学状况与神经病理学及癫痫结局的关系。癫痫行为 (2002) 3:76–81。doi:10.1006/ebeh.2001.0297
59. Neville BG,Harkness WF,Cross JH,Cass HC,Burch VC,Lees JA 等。儿童癫痫严重自闭症退化的外科治疗。Pediatr Neurol(1997)16:137–40。DOI:10.1016/S0887-8994(96)00297-4
60. Lewine JD,Andrews R,Chez M,Patil AA,Devinsky O,Smith M 等。退行性自闭症谱系障碍儿童癫痫样活动的脑磁图模式。《儿科学》(1999)104:405–18。doi:10.1542/peds.104.3.405
61. Nass R, Gross A, Wisoff J, Devinsky O. 自闭症癫痫样回归多重亚鞘皮切断的结果。Pediatr Neurol(1999)21:464–70。doi:10.1016/S0887-8994(99)00029-6
62. Schramm J, Aliashkevich AF, Grunwald T. 多重皮下切开术:20名未接受切除患者的结局及并发症。神经外科杂志(2002)97:39–47。doi:10.3171/jns.2002.97.1.0039
63. Blount JP、Langburt W、Otsubo H、Chitoku S、Ochi A、Weiss S等。多重皮下切断在儿科癫痫治疗中的应用。《神经外科杂志》(2004)100:118–24。
64. Ntsambi-Eba G, Vaz G, Docquier MA, van Rijckevorsel K, Raftopoulos C. 使用改良型多层皮下切断技术治疗难治性癫痫患者。神经外科(2013) 72:890–897;讨论 897–898。doi:10.1227/NEU.0b013e31828ba750
65. 斯特凡纳托斯 GA,格罗弗·W,盖勒·E。案例研究:皮质类固醇治疗广泛性发育障碍中语言倒退。《美国学术儿童青少年精神病学杂志》(1995)34:1107–11。DOI:10.1097/00004583-199508000-00022
66. Shenoy S, Arnold S, Chatila T. 自身免疫性淋巴增殖综合征继发自闭症对类固醇治疗的反应。《儿科学杂志》(2000) 136:682–7。doi:10.1067/mpd.2000.105355
67. Chez MG, Loeffel M, Buchanan C. 脉冲高剂量类固醇作为瘤酸联合治疗患有广泛性发育迟缓或自闭症的癫痫性失语症患者。Ann Neurol (1998) 44:539。
68. 格罗索·S,法内塔尼·M,莫斯塔迪尼·R,科德利·D,贝拉尔迪·R,巴莱斯特里·P。氢化可的松与去氟沙康特在儿童耐药性癫痫中的比较研究。癫痫研究(2008)81:80–5。doi:10.1016/j.eplepsyres.2008.04.016
69. 余SJ、郑德、金HD、李HS、姜HC。儿科癫痫短期泼尼松龙治疗的疗效与预后。《欧洲儿科神经学杂志》(2008)12:314–20。doi:10.1016/j.ejpn.2007.09.003
70. 鲍里斯·M,戈德布拉特·A,埃德尔森 SM。静脉注射伽马球蛋白治疗自闭症儿童的改善。《环境医学杂志》(2005年)15:169–76。doi:10.1080/13590840600681827
71. Gupta S. 静脉注射免疫球蛋白治疗自闭症儿童。《儿童神经学杂志》(1999年)14:203–205。
72. DelGiudice-Asch G, Simon L, Schmeidler J, Cunningham-Rundles C, Hollander E. 简要报告:儿童自闭症静脉注射免疫球蛋白的开放临床试验。《自闭症发展研究杂志》(1999)29:157–60。doi:10.1023/A:1023096728131
73. Plioplys AV。静脉注射自闭症儿童免疫球蛋白治疗。《儿童神经杂志》(1998)13:79–82。doi:10.1177/088307389801300207
74. van Engelen BG,Renier WO,Weemaes CM。人类及实验性癫痫中的免疫球蛋白治疗。《神经外科精神病学杂志》(1994)57(增刊):72–75。doi:10.1136/jnnp.57.Suppl.72
75. van Engelen BG, Renier WO, Weemaes CM, Gabreels FJ, Meinardi H. 癫痫中的免疫球蛋白治疗,文献综述。《癫痫研究》(1994)19:181–90。doi:10.1016/0920-1211(94)90061-2
76. Billiau AD, Witters P, Ceulemans B, Kasran A, Wouters C, Lagae L. 难治性儿童发作癫痫中的静脉注射免疫球蛋白:对癫痫发作频率、脑电图活动及脑脊髓液细胞因子谱的影响。癫痫(2007)48:1739–1749。DOI:10.1111/J.1528-1167.2007.01134.x
77. Mikati MA, Kurdi R, El-Khoury Z, Rahi A, Raad W. 难治性儿童癫痫中的静脉注射免疫球蛋白治疗:开放标签研究与文献综述。癫痫行为(2010)17:90–4。doi:10.1016/j.yebeh.2009.10.020
78. 科本 R,林登 M,迈尔斯 近端锋。自闭症谱系障碍的神经反馈:文献综述。应用《心理生理生物反馈》(2010)35:83–105。DOI:10.1007/S10484-009-9117-y
79. Sterman MB. Basic concepts and clinical findings in the treatment of seizure disorders with EEG operant conditioning. Clin Electroencephalogr (2000) 31:45–55.
80. Tan G, Thornby J, Hammond DC, Strehl U, Canady B, Arnemann K, et al. Meta-analysis of EEG biofeedback in treating epilepsy. Clin EEG Neurosci (2009) 40:173–9. doi:10.1177/155005940904000310
81. Coben R. Neurofeedback for autistic disorders: emerging empirical evidence. In: Casanova MF, editor. Imaging the Brain in Autism. New York: Springer Science+Business Media (2013). p. 107–34.
82. Coben R, Padolsky I. Assessment-guided neurofeedback for autistic spectrum disorder. J Neurother (2007) 11:5–23. doi:10.1300/J184v11n01_02
83. Kouijzer MEJ, de Moor JMH, Gerrits BJL, Congedo M, van Schie HT. Neurofeedback improves executive functioning in children with autism spectrum disorders. Res Autism Spectr Disord (2009) 3:145–62. doi:10.1016/j.rasd.2008.05.001
84. Kouijzer MEJ, van Schie HT, de Moor JMH, Gerrits BJL, Congedo M, Buitelaar JK. Neurofeedback improves executive functioning in children with autism spectrum disorders. Res Autism Spectr Disord (2010) 4:386–99. doi:10.1016/j.rasd.2009.10.007
85. Coben R, McKeon K. EEG assessment and treatment for autism spectrum disorders. Autism File (2009) 32:40–7.
86. Coben R, McKeon K. EEG assessment and treatment of seizures in children with autism spectrum disorder: a case example. Neuroconnections (2009): p. 17–2.
87. Legarda SB, McMahon D, Othmer S, Othmer S. Clinical neurofeedback: case studies, proposed mechanism, and implications for pediatric neurology practice. J Child Neurol (2011) 26:1045–51. doi:10.1177/0883073811405052
88. Jambaque I, Chiron C, Dumas C, Mumford J, Dulac O. Mental and behavioural outcome of infantile epilepsy treated by vigabatrin in tuberous sclerosis patients. Epilepsy Res (2000) 38:151–60. doi:10.1016/S0920-1211(99)00082-0
89. Bombardieri R, Pinci M, Moavero R, Cerminara C, Curatolo P. Early control of seizures improves long-term outcome in children with tuberous sclerosis complex. Eur J Paediatr Neurol (2010) 14:146–9. doi:10.1016/j.ejpn.2009.03.003
90. Cusmai R, Moavero R, Bombardieri R, Vigevano F, Curatolo P. 早发性癫痫与结节性硬化症相关儿童的长期神经系统结局。癫痫行为(2011)22:735–9。doi:10.1016/j.yebeh.2011.08.037
91. Humphrey A, Neville BG, Clarke A, Bolton PF. 与结节性硬化婴儿癫痫发作相关的自闭症倒退。Dev Med Child Neurol(2006)48:609–11。doi:10.1111/j.1469-8749.2006.tb01324.x
92. Chiron C, Dumas C, Jambaque I, Mumford J, Dulac O. 一项随机试验,比较维加巴特林和氢化可的松在结节性硬化症引起的婴儿痉挛中。癫痫研究(1997)26:389–95。doi:10.1016/S0920-1211(96)01006-6
93. Schaefer GB,Mendelsohn 新泽西,专业P,指南C。临床遗传学评估在识别自闭症谱系障碍病因中的应用:2013年指南修订。Genet Med (2013) 15:399–407。doi:10.1038/gim.2013.32
94. Berry-Kravis E. 脆性X综合征中的癫痫。Dev Med Child Neurol(2002)44:724–8。doi:10.1111/j.1469-8749.2002.tb00277.x
95. Incorpora G, Sorge G, Sorge A, Pavone L. 脆性X综合征中的癫痫。《脑开发》(2002)24:766–9。doi:10.1016/S0387-7604(02)00102-X
96. 阿拉奈·Y,乌纳尔·F,图兰利·G,阿利卡西福格鲁·M,阿莱汉·D,阿基奥尔·U,等。多学科方法管理脆弱X综合征患者。《智力障碍杂志》(2007)51:151–61。DOI:10.1111/J.1365-2788.2006.00942.x
97. 贝里-克拉维斯 E,拉斯帕 M,洛金-赫斯特 L,主教 E,霍利迪 D,贝利 DB。脆性X综合征中的癫痫发作:特征与合并诊断。《智力障碍杂志》(2010)115:461–72。DOI:10.1352/1944-7558-115.6.461
98. 曹Z、胡尔西泽S、塔松F、唐HT、哈格曼RJ、罗加夫斯基MA等。FMR1前突变海马神经元的聚集爆发放电:异体降格纳诺隆的缓解。《人类分子基因》(2012)21:2923–35。DOI:10.1093/HMG/DDS118
99. 休伦斯 I, D'Hulst C, 范·达姆 D, 德·戴因 PP, 库伊 RF. 用GABA能药物在敲除小鼠模型中治疗脆性X综合征。《Behav Brain Res (2012)229:244–9》。doi:10.1016/j.bbr.2012.01.031
100. Wijetunge LS,Chattarji S,Wyllie DJ,Kind PC。脆性X综合征:从靶点到治疗。神经药理学(2013)68:83–96。DOI:10.1016/J.Neuropharm.2012.11.028
101. 奥斯特韦尔 EK、庄 SC、楚比金 AA、西多罗夫 M、比安奇 R、黄 RK 等洛伐他汀在脆性X综合征小鼠模型中纠正过量蛋白质合成,并预防癫痫发生。Neuron(2013)77:243–50。doi:10.1016/j.neuron.2012.01.034
102. 矿业,MA,乔普·RS。糖原合酶激酶-3:脆弱X综合征的有望治疗靶点。《前分子神经科学》(2011)4:35。DOI:10.3389/fnmol.2011.00035
103. Frye RE, Rossignol D. 与自闭症谱系障碍相关的代谢疾病和异常。《儿科生物化学杂志》(2012)2:181–91。
104. Fillano JJ, Goldenthal MJ, Rhodes CH, Marin-Garcia J. 低张力、癫痫、自闭症和发育迟缓患者的线粒体功能障碍:HEADD综合征。《儿童神经杂志》(2002)17:435–439。DOI:10.1177/088307380201700607
105. 帕里克·S,萨内托·R,福尔克·MJ,安塞尔姆·I,科恩·BH,哈斯·R,等人。一种现代的线粒体疾病治疗方法。Curr Treat Options Neurol(2009)11:414–30。DOI:10.1007/S11940-009-0046-0
106. Frye RE, Rossignol D. 与自闭症谱系障碍相关的线粒体功能障碍治疗。《儿童生物化学杂志》(2012)2:241–249。
107. 罗西尼奥尔地区检察官,弗莱 RE自闭症谱系障碍中的线粒体功能障碍:系统综述与荟萃分析。《分子精神病学》(2012)17:290–314。doi:10.1038/mp.2010.136
108. 盖尔·达·达、克恩·JK、戴维斯·G、金·守卫、亚当斯·JB、杨·JL等。一项左旋肉碱的前瞻性双盲、随机临床试验,用于治疗自闭症谱系障碍。医学科学研究(2011)17:I15–23。doi:10.12659/MSM.881792
109. 法赫米SF,埃尔-哈马姆西MH,扎基OK,巴达里OA。L-肉碱补充剂能改善自闭症儿童的行为症状。Res Autism Spectr Disord(2013)7:159–66。doi:10.1016/j.rasd.2012.07.006
110. Adams JB, Holloway C. Pilot study of a moderate dose multivitamin/mineral supplement for children with autistic spectrum disorder. J Altern Complement Med (2004) 10:1033–9. doi:10.1089/acm.2004.10.1033
111. Adams JB, Audhya T, McDonough-Means S, Rubin RA, Quig D, Geis E, et al. Effect of a vitamin/mineral supplement on children and adults with autism. BMC Pediatr (2011) 11:111. doi:10.1186/1471-2431-11-111
112. Hardan AY, Fung LK, Libove RA, Obukhanych TV, Nair S, Herzenberg LA, et al. A randomized controlled pilot trial of oral N-acetylcysteine in children with autism. Biol Psychiatry (2012) 71:956–61. doi:10.1016/j.biopsych.2012.01.014
113. Ghanizadeh A, Moghimi-Sarani E. A randomized double blind placebo controlled clinical trial of N-acetylcysteine added to risperidone for treating autistic disorders. BMC Psychiatry (2013) 13:196. doi:10.1186/1471-244X-13-196
114. Ghanizadeh A, Derakhshan N. N-acetylcysteine for treatment of autism, a case report. J Res Med Sci (2012) 17:985–7.
115. Obeid R, McCaddon A, Herrmann W. The role of hyperhomocysteinemia and B-vitamin deficiency in neurological and psychiatric diseases. Clin Chem Lab Med (2007) 45:1590–606. doi:10.1515/CCLM.2007.356
116. Boris M, Goldblatt A, Galanko J, James SJ. Association of MTHFR gene variants with autism. J Ind Hyg Toxicol (2004) 9:106–8.
117. James SJ, Melnyk S, Jernigan S, Cleves MA, Halsted CH, Wong DH, et al. Metabolic endophenotype and related genotypes are associated with oxidative stress in children with autism. Am J Med Genet B Neuropsychiatr Genet (2006) 141B:947–56. doi:10.1002/ajmg.b.30366
118. Goin-Kochel RP, Porter AE, Peters SU, Shinawi M, Sahoo T, Beaudetal . The MTHFR 677C–>T polymorphism and behaviors in children with autism: exploratory genotype-phenotype correlations. Autism Res (2009) 2:98–108. doi:10.1002/aur.70
119. Mohammad NS, Jain JM, Chintakindi KP, Singh RP, Naik U, Akella RR. Aberrations in folate metabolic pathway and altered susceptibility to autism. Psychiatr Genet (2009) 19:171–6. doi:10.1097/YPG.0b013e32832cebd2
120. Pasca SP, Dronca E, Kaucsar T, Craciun EC, Endreffy E, Ferencz BK, et al. One carbon metabolism disturbances and the C677T MTHFR gene polymorphism in children with autism spectrum disorders. J Cell Mol Med (2009) 13:4229–38. doi:10.1111/j.1582-4934.2008.00463.x
121. Liu X, Solehdin F, Cohen IL, Gonzalez MG, Jenkins EC, Lewis ME, et al. Population- and family-based studies associate the MTHFR gene with idiopathic autism in simplex families. J Autism Dev Disord (2011) 41:938–44. doi:10.1007/s10803-010-1120-x
122. Frustaci A, Neri M, Cesario A, Adams JB, Domenici E, Dalla Bernardina B, et al. Oxidative stress-related biomarkers in autism: systematic review and meta-analyses. Free Radic Biol Med (2012) 52:2128–41. doi:10.1016/j.freeradbiomed.2012.03.011
123. Guo T, Chen H, Liu B, Ji W, Yang C. Methylenetetrahydrofolate reductase polymorphisms C677T and risk of autism in the Chinese Han population. Genet Test Mol Biomarkers (2012) 16:968–73. doi:10.1089/gtmb.2012.0091
124. Schmidt RJ, Tancredi DJ, Ozonoff S, Hansen RL, Hartiala J, Allayee H, et al. Maternal periconceptional folic acid intake and risk of autism spectrum disorders and developmental delay in the CHARGE (CHildhood Autism Risks from Genetics and Environment) case-control study. Am J Clin Nutr (2012) 96:80–9. doi:10.3945/ajcn.110.004416
125. Pu D, Shen Y, Wu J. Association between MTHFR gene polymorphisms and the risk of autism spectrum disorders: a meta-analysis. Autism Res (2013). doi:10.1002/aur.1300. [Epub ahead of print].
126. Adams M, Lucock M, Stuart J, Fardell S, Baker K, Ng X. Preliminary evidence for involvement of the folate gene polymorphism 19bp deletion-DHFR in occurrence of autism. Neurosci Lett (2007) 422:24–9. doi:10.1016/j.neulet.2007.05.025
127. Frye RE, Sequeira JM, Quadros EV, James SJ, Rossignol DA. Cerebral folate receptor autoantibodies in autism spectrum disorder. Mol Psychiatry (2013) 18:369–81. doi:10.1038/mp.2011.175
128. Ramaekers VT, Quadros EV, Sequeira JM. Role of folate receptor autoantibodies in infantile autism. Mol Psychiatry (2013) 18:270–1. doi:10.1038/mp.2012.22
129. Frye RE, Naviaux RK. Autistic disorder with complex IV overactivity: a new mitochondrial syndrome. J Ped Neurol (2011) 9:427–34.
130. Ramaekers VT, Sequeira JM, Blau N, Quadros EV. A milk-free diet downregulates folate receptor autoimmunity in cerebral folate deficiency syndrome. Dev Med Child Neurol (2008) 50:346–52. doi:10.1111/j.1469-8749.2008.02053.x
131. Moretti P, Sahoo T, Hyland K, Bottiglieri T, Peters S, Del Gaudio D, et al. Cerebral folate deficiency with developmental delay, autism, and response to folinic acid. Neurology (2005) 64:1088–90. doi:10.1212/01.WNL.0000154641.08211.B7
132. Ramaekers VT, Rothenberg SP, Sequeira JM, Opladen T, Blau N, Quadros EV, et al. Autoantibodies to folate receptors in the cerebral folate deficiency syndrome. N Engl J Med (2005) 352:1985–91. doi:10.1056/NEJMoa043160
133. Moretti P, Peters SU, Del Gaudio D, Sahoo T, Hyland K, Bottiglieri T, et al. Brief report: autistic symptoms, developmental regression, mental retardation, epilepsy, and dyskinesias in CNS folate deficiency. J Autism Dev Disord (2008) 38:1170–7. doi:10.1007/s10803-007-0492-z
134. Ramaekers VT, Blau N, Sequeira JM, Nassogne MC, Quadros EV. Folate receptor autoimmunity and cerebral folate deficiency in low-functioning autism with neurological deficits. Neuropediatrics (2007) 38:276–81. doi:10.1055/s-2008-1065354
135. Frye RE, Donner E, Golja A, Rooney CM. Folinic acid-responsive seizures presenting as breakthrough seizures in a 3-month-old boy. J Child Neurol (2003) 18:562–9. doi:10.1177/08830738030180081001
136. Djukic A. Folate-responsive neurologic diseases. Pediatr Neurol (2007) 37:387–97. doi:10.1016/j.pediatrneurol.2007.09.001
137. Gallagher RC, Van Hove JL, Scharer G, Hyland K, Plecko B, Waters PJ, et al. Folinic acid-responsive seizures are identical to pyridoxine-dependent epilepsy. Ann Neurol (2009) 65:550–6. doi:10.1002/ana.21568
138. Gorker I, Tuzun U. Autistic-like findings associated with a urea cycle disorder in a 4-year-old girl. J Psychiatry Neurosci (2005) 30:133–5.
139. Serrano M, Martins C, Perez-Duenas B, Gomez-Lopez L, Murgui E, Fons C, et al. Neuropsychiatric manifestations in late-onset urea cycle disorder patients. J Child Neurol (2010) 25:352–8. doi:10.1177/0883073809340696
140. Braissant O. Current concepts in the pathogenesis of urea cycle disorders. Mol Genet Metab (2010) 100(Suppl 1):S3–12. doi:10.1016/j.ymgme.2010.02.010
141. van Karnebeek CD, Stockler S. Treatable inborn errors of metabolism causing intellectual disability: a systematic literature review. Mol Genet Metab (2012) 105:368–81. doi:10.1016/j.ymgme.2011.11.191
142. Pearl PL, Gibson KM, Cortez MA, Wu Y, Carter Snead O III, Knerr I, et al. Succinic semialdehyde dehydrogenase deficiency: lessons from mice and men. J Inherit Metab Dis (2009) 32:343–52. doi:10.1007/s10545-009-1034-y
143. Schulze A. Creatine deficiency syndromes. Mol Cell Biochem (2003) 244:143–50. doi:10.1023/A:1022443503883
144. Zaffanello M, Zamboni G, Fontana E, Zoccante L, Tato L. A case of partial biotinidase deficiency associated with autism. Child Neuropsychol (2003) 9:184–8. doi:10.1076/chin.9.3.184.16457
145. Sikora DM, Pettit-Kekel K, Penfield J, Merkens LS, Steiner RD. The near universal presence of autism spectrum disorders in children with Smith-Lemli-Opitz syndrome. Am J Med Genet A (2006) 140:1511–8.
146. Bukelis I, Porter FD, Zimmerman AW, Tierney E. Smith-Lemli-Opitz syndrome and autism spectrum disorder. Am J Psychiatry (2007) 164:1655–61. doi:10.1176/appi.ajp.2007.07020315
147. Martin A, Koenig K, Scahill L, Tierney E, Porter FD, Nwokoro NA. Smith-Lemli-Opitz syndrome. J Am Acad Child Adolesc Psychiatry (2001) 40:506–7. doi:10.1097/00004583-200105000-00008
148. Elias ER, Irons MB, Hurley AD, Tint GS, Salen G. Clinical effects of cholesterol supplementation in six patients with the Smith-Lemli-Opitz syndrome (SLOS). Am J Med Genet (1997) 68:305–10. doi:10.1002/(SICI)1096-8628(19970131)68:3<305::AID-AJMG11>3.0.CO;2-X
149. Irons M, Elias ER, Abuelo D, Bull MJ, Greene CL, Johnson VP, et al. Treatment of Smith-Lemli-Opitz syndrome: results of a multicenter trial. Am J Med Genet (1997) 68:311–4. doi:10.1002/(SICI)1096-8628(19970131)68:3<311::AID-AJMG12>3.3.CO;2-8
150. Nwokoro NA, Mulvihill JJ. Cholesterol and bile acid replacement therapy in children and adults with Smith-Lemli-Opitz (SLO/RSH) syndrome. Am J Med Genet (1997) 68:315–21. doi:10.1002/(SICI)1096-8628(19970131)68:3<315::AID-AJMG13>3.0.CO;2-W
151. Aneja A, Tierney E. Autism: the role of cholesterol in treatment. Int Rev Psychiatry (2008) 20:165–70. doi:10.1080/09540260801889062
152. Tierney E, Conley SK, Goodwin H, Porter FD. Analysis of short-term behavioral effects of dietary cholesterol supplementation in Smith-Lemli-Opitz syndrome. Am J Med Genet A (2010) 152A:91–5. doi:10.1002/ajmg.a.33148
153. Novarino G, El-Fishawy P, Kayserili H, Meguid NA, Scott EM, Schroth J, et al. Mutations in BCKD-kinase lead to a potentially treatable form of autism with epilepsy. Science (2012) 338:394–7. doi:10.1126/science.1224631
154. Dufour F, Nalecz KA, Nalecz MJ, Nehlig A. Modulation of absence seizures by branched-chain amino acids: correlation with brain amino acid concentrations. Neurosci Res (2001) 40:255–63. doi:10.1016/S0168-0102(01)00232-2
155. Fox JT, Tullidge GM. Pyridoxine (vitamin B6) in epilepsy; a clinical trial. Lancet (1946) 2:345. doi:10.1016/S0140-6736(46)90842-2
156. Ernsting W, Ferwerda T. Vitamin B6 in treatment of epilepsy. J Am Med Assoc (1952) 148:1540.
157. 焦菲、高迪、拓马Y、吴S、刘子、张XK等。一项针对儿童复发性癫痫治疗中高剂量静脉注射吡哆醇的随机对照试验。《儿童神经》(1997)17:54–7。doi:10.1016/S0887-8994(97)00035-0
158. 中川 E, Tanaka T, Ohno M, Yamano T, Shimada M. 吡荆醛磷酸盐治疗难治性癫痫患者治疗的疗效。神经学(1997)48:1468–1469。doi:10.1212/WNL.48.5.1468
159. 斯托克勒 S,普莱科 B,戈斯佩 SM Jr,库尔特-麦基 M,康诺利 M,范·卡内贝克 C 等。吡哆醇依赖性癫痫和抗古素缺乏症:临床和分子特征及诊断、治疗和随访建议。Mol Genet Metab(2011)104:48–60。doi:10.1016/j.ymgme.2011.05.014
160. 希利空军,罗伯茨将军。一项关于精神病儿童色氨酸代谢的研究。Dev Med Child Neurol(1966年)8:708–718。DOI:10.1111/J.1469-8749.1966.TB01830.x
161. Bonisch E. 关于自闭症脑损伤儿童使用嘻噻嗪的经历。《儿童心理实践》(1968年)17:308–10。
162. Rimland B. 治疗严重精神障碍儿童中某些维生素的高剂量。载于:霍金斯·D,鲍林·L,主编。正分子精神病学。纽约:W.H. 弗里曼(1973年)。第513–538页。
163. 里姆兰德B,卡拉威E,德雷福斯P。高剂量维生素B6对自闭症儿童的影响:一项双盲交叉研究。《精神病学杂志》(1978年)135:472–475。
164. Martineau J, Barthelemy C, Garreau B, Lelord G. 维生素B6、镁及联合维生素B6-Mg:儿童自闭症的治疗效果。《生物精神病学》(1985年)20:467–478。DOI:10.1016/0006-3223(85)90019-8
165. 伯德·L,斯特内赫姆·A,弗朗切斯基尼·LA,克尔贝希安·J。对一名患有吡哆醇(维生素B6)依赖癫痫发作、患有自闭症、屏气和严重智力障碍的男孩进行了15年的随访。《儿童神经学杂志》(2000年)15:763–765。doi:10.1177/088307380001501111
166. 本比尔·G,乌伊萨尔·S,萨尔蒂克·S,泽贝克·CA,艾丁·A,德尔文特·A,等。治疗维生素B12缺乏时的癫痫发作。《癫痫发作》(2007)16:69–73。doi:10.1016/j.seizure.2006.10.016
167. Erol I, Alehan F, Gumus A. 维生素B12缺乏的婴儿韦斯特综合征,且无大细胞性贫血。Dev Med Child Neurol(2007)49:774–6。doi:10.1111/j.1469-8749.2007.00774.x
168. 詹姆斯·SJ,梅尔尼克·S,福克斯·G,里德·T,杰尼根·S,帕夫利夫·O等。甲钴胺素和叶林酸治疗对自闭症儿童谷胱甘肽氧化还原状态的疗效。美国杂志《克林·努特尔》(2009年)89:425–30。doi:10.3945/AJCN.2008.26615
169. N 和俊、N 直子、T惠美子、Man U、Mituki T、N 智宏 等。甲钴胺治疗在自闭症中的初步研究。《东京女子医学大学杂志》(2005年)75卷,64–69页。
170. 托普库 M,萨蒂·I,哈利洛格鲁·G,凯西默·M,科斯昆·T。一名六个月大男婴出现的D-甘油酸尿症,表现出韦斯特综合征和自闭症行为。《神经儿科学》(2002年)33:47–50。DOI:10.1055/s-2002-23600
171. Al-Owain M, Kaya N, Al-Shamrani H, Al-Bakheet A, Qari A, Al-Muaigl S, et al. Autism spectrum disorder in a child with propionic acidemia. JIMD Rep (2013) 7:63–6. doi:10.1007/8904_2012_143
172. Zafeiriou DI, Ververi A, Salomons GS, Vargiami E, Haas D, Papadopoulou V, et al. L-2-hydroxyglutaric aciduria presenting with severe autistic features. Brain Dev (2008) 30:305–7. doi:10.1016/j.braindev.2007.09.005
173. Lofthouse N, Hendren R, Hurt E, Arnold LE, Butter E. A review of complementary and alternative treatments for autism spectrum disorders. Autism Res Treat (2012) 2012:870391. doi:10.1155/2012/870391
174. Ault B, Evans RH, Francis AA, Oakes DJ, Watkins JC. Selective depression of excitatory amino acid induced depolarizations by magnesium ions in isolated spinal cord preparations. J Physiol (1980) 307:413–28.
175. Hallak M. Effect of parenteral magnesium sulfate administration on excitatory amino acid receptors in the rat brain. Magnes Res (1998) 11:117–31.
176. Hallak M, Berman RF, Irtenkauf SM, Evans MI, Cotton DB. Peripheral magnesium sulfate enters the brain and increases the threshold for hippocampal seizures in rats. Am J Obstet Gynecol (1992) 167:1605–10. doi:10.1016/0002-9378(92)91749-Z
177. Mathern GW, Pretorius JK, Mendoza D, Lozada A, Leite JP, Chimelli L, et al. Increased hippocampal AMPA and NMDA receptor subunit immunoreactivity in temporal lobe epilepsy patients. J Neuropathol Exp Neurol (1998) 57:615–34. doi:10.1097/00005072-199806000-00008
178. Mikuni N, Babb TL, Ying Z, Najm I, Nishiyama K, Wylie C, et al. NMDA-receptors 1 and 2A/B coassembly increased in human epileptic focal cortical dysplasia. Epilepsia (1999) 40:1683–7. doi:10.1111/j.1528-1157.1999.tb01584.x
179. Chaistitwanich R, Mahoney AW, Hendricks DG, Sisson DV. Dietary calcium and phosphorus and seizure susceptibility of magnesium deficient rats. Pharmacol Biochem Behav (1987) 27:443–9. doi:10.1016/0091-3057(87)90347-9
180. Sinert R, Zehtabchi S, Desai S, Peacock P, Altura BT, Altura BM. Serum ionized magnesium and calcium levels in adult patients with seizures. Scand J Clin Lab Invest (2007) 67:317–26. doi:10.1080/00365510601051441
181. Gupta SK, Manhas AS, Gupta VK, Bhatt R. Serum magnesium levels in idiopathic epilepsy. J Assoc Physicians India (1994) 42:456–7.
182. Hunter LA, Gibbins KJ. Magnesium sulfate: past, present, and future. J Midwifery Womens Health (2011) 56:566–74. doi:10.1111/j.1542-2011.2011.00121.x
183. Zou LP, Wang X, Dong CH, Chen CH, Zhao W, Zhao RY. Three-week combination treatment with ACTH + magnesium sulfate versus ACTH monotherapy for infantile spasms: a 24-week, randomized, open-label, follow-up study in China. Clin Ther (2010) 32:692–700. doi:10.1016/j.clinthera.2010.04.008
184. Abdelmalik PA, Politzer N, Carlen PL. Magnesium as an effective adjunct therapy for drug resistant seizures. Can J Neurol Sci (2012) 39:323–7.
185. Shorvon S, Ferlisi M. The outcome of therapies in refractory and super-refractory convulsive status epilepticus and recommendations for therapy. Brain (2012) 135:2314–28. doi:10.1093/brain/aws091
186. Visser NA, Braun KP, Leijten FS, van Nieuwenhuizen O, Wokke JH, van den Bergh WM. Magnesium treatment for patients with refractory status epilepticus due to POLG1-mutations. J Neurol (2011) 258:218–22. doi:10.1007/s00415-010-5721-2
187. Lelord G, Muh JP, Barthelemy C, Martineau J, Garreau B, Callaway E. Effects of pyridoxine and magnesium on autistic symptoms – initial observations. J Autism Dev Disord (1981) 11:219–30. doi:10.1007/BF01531686
188. Lelord G, Callaway E, Muh JP. Clinical and biological effects of high doses of vitamin B6 and magnesium on autistic children. Acta Vitaminol Enzymol (1982) 4:27–44.
189. Findling RL, Maxwell K, Scotese-Wojtila L, Huang J, Yamashita T, Wiznitzer M. High-dose pyridoxine and magnesium administration in children with autistic disorder: an absence of salutary effects in a double-blind, placebo-controlled study. J Autism Dev Disord (1997) 27:467–78. doi:10.1023/A:1025861522935
190. Tolbert L, Haigler T, Waits MM, Dennis T. Brief report: lack of response in an autistic population to a low dose clinical trial of pyridoxine plus magnesium. J Autism Dev Disord (1993) 23:193–9. doi:10.1007/BF01066428
191. Kaluzna-Czaplinska J, Socha E, Rynkowski J. B vitamin supplementation reduces excretion of urinary dicarboxylic acids in autistic children. Nutr Res (2011) 31:497–502. doi:10.1016/j.nutres.2011.06.002
192. Faber S, Zinn GM, Kern JC II, Kingston HM. The plasma zinc/serum copper ratio as a biomarker in children with autism spectrum disorders. Biomarkers (2009) 14:171–80. doi:10.1080/13547500902783747
193. Yasuda H, Yoshida K, Yasuda Y, Tsutsui T. Infantile zinc deficiency: association with autism spectrum disorders. Sci Rep (2011) 1:129. doi:10.1038/srep00129
194. Jackson MJ, Garrod PJ. Plasma zinc, copper, and amino acid levels in the blood of autistic children. J Autism Child Schizophr (1978) 8:203–8. doi:10.1007/BF01537869
195. Adams JB, Audhya T, McDonough-Means S, Rubin RA, Quig D, Geis E, et al. Nutritional and metabolic status of children with autism vs. neurotypical children, and the association with autism severity. Nutr Metab (Lond) (2011) 8:34. doi:10.1186/1743-7075-8-34
196. Ganesh R, Janakiraman L. Serum zinc levels in children with simple febrile seizure. Clin Pediatr (Phila) (2008) 47:164–6. doi:10.1177/0009922807306165
197. Mollah MA, Rakshit SC, Anwar KS, Arslan MI, Saha N, Ahmed S, et al. Zinc concentration in serum and cerebrospinal fluid simultaneously decrease in children with febrile seizure: findings from a prospective study in Bangladesh. Acta Paediatr (2008) 97:1707–11. doi:10.1111/j.1651-2227.2008.01001.x
198. Farahani HN, Ashthiani AR, Masihi MS. Study on serum zinc and selenium levels in epileptic patients. Neurosciences (2013) 18:138–42.
199. Seven M, Basaran SY, Cengiz M, Unal S, Yuksel A. Deficiency of selenium and zinc as a causative factor for idiopathic intractable epilepsy. Epilepsy Res (2013) 104:35–9. doi:10.1016/j.eplepsyres.2012.09.013
200. Williamson A, Spencer D. Zinc reduces dentate granule cell hyperexcitability in epileptic humans. Neuroreport (1995) 6:1562–4. doi:10.1097/00001756-199507310-00024
201. Fukahori M, Itoh M. Effects of dietary zinc status on seizure susceptibility and hippocampal zinc content in the El (epilepsy) mouse. Brain Res (1990) 529:16–22. doi:10.1016/0006-8993(90)90806-M
202. Roach ES, Carlin L. N,N-dimethylglycine for epilepsy. N Engl J Med (1982) 307:1081–2. doi:10.1056/NEJM198210213071717
203. Roach ES, Gibson P. Failure of N,N-dimethylglycine in epilepsy. Ann Neurol (1983) 14:347. doi:10.1002/ana.410140314
204. Gascon G, Patterson B, Yearwood K, Slotnick H. N,N-dimethylglycine and epilepsy. Epilepsia (1989) 30:90–3. doi:10.1111/j.1528-1157.1989.tb05288.x
205. Bolman WM, Richmond JA. A double-blind, placebo-controlled, crossover pilot trial of low dose dimethylglycine in patients with autistic disorder. J Autism Dev Disord (1999) 29:191–4. doi:10.1023/A:1023023820671
206. Kern JK, Miller VS, Cauller PL, Kendall PR, Mehta PJ, Dodd M. Effectiveness of N,N-dimethylglycine in autism and pervasive developmental disorder. J Child Neurol (2001) 16:169–73. doi:10.2310/7010.2001.17515
207. Barbeau A, Donaldson J. Zinc, taurine, and epilepsy. Arch Neurol (1974) 30:52–8. doi:10.1001/archneur.1974.00490310054009
208. Bergamini L, Mutani R, Delsedime M, Durelli L. First clinical experience on the antiepileptic action of taurine. Eur Neurol (1974) 11:261–9. doi:10.1159/000114324
209. Barbeau A, Inoue N, Tsukada Y, Butterworth RF. The neuropharmacology of taurine. Life Sci (1975) 17:669–77. doi:10.1016/0024-3205(75)90520-2
210. El Idrissi A, Messing J, Scalia J, Trenkner E. Prevention of epileptic seizures by taurine. Adv Exp Med Biol (2003) 526:515–25. doi:10.1007/978-1-4615-0077-3_62
211. El Idrissi A, L’Amoreaux WJ. Selective resistance of taurine-fed mice to isoniazide-potentiated seizures: in vivo functional test for the activity of glutamic acid decarboxylase. Neuroscience (2008) 156:693–9. doi:10.1016/j.neuroscience.2008.07.055
212. Davison AN, Kaczmarek LK. Taurine – a possible neurotransmitter? Nature (1971) 234:107–8. doi:10.1038/234107a0
213. Knerr I, Pearl PL, Bottiglieri T, Snead OC, Jakobs C, Gibson KM. Therapeutic concepts in succinate semialdehyde dehydrogenase (SSADH; ALDH5a1) deficiency (gamma-hydroxybutyric aciduria). Hypotheses evolved from 25 years of patient evaluation, studies in Aldh5a1-/- mice and characterization of gamma-hydroxybutyric acid pharmacology. J Inherit Metab Dis (2007) 30:279–94. doi:10.1007/s10545-007-0574-2
214. Geier DA, Kern JK, Garver CR, Adams JB, Audhya T, Geier MR. A prospective study of transsulfuration biomarkers in autistic disorders. Neurochem Res (2009) 34:386–93. doi:10.1007/s11064-008-9782-x
215. El Idrissi A, Boukarrou L, Dokin C, Brown WT. Taurine improves congestive functions in a mouse model of fragile X syndrome. Adv Exp Med Biol (2009) 643:191–8. doi:10.1007/978-0-387-75681-3_19
216. Marchesi GF, Quattrini A, Scarpino O, Dellantonio R. Therapeutic effects of taurine in epilepsy: a clinical and polyphysiographic study (author’s transl). Riv Patol Nerv Ment (1975) 96:166–84.
217. Fukuyama Y, Ochiai Y. Therapeutic trial by taurine for intractable childhood epilepsies. Brain Dev (1982) 4:63–9. doi:10.1016/S0387-7604(82)80103-4
218. Koivisto K, Sivenius J, Keranen T, Partanen J, Riekkinen P, Gothoni G, et al. Clinical trial with an experimental taurine derivative, taltrimide, in epileptic patients. Epilepsia (1986) 27:87–90. doi:10.1111/j.1528-1157.1986.tb03506.x
219. Airaksinen EM, Koivisto K, Keranen T, Pitkanen A, Riekkinen PJ, Oja SS, et al. Biochemical and clinical studies on epileptic patients during two phase I trials with the novel anticonvulsant taltrimide. Epilepsy Res (1987) 1:308–11. doi:10.1016/0920-1211(87)90008-8
220. Kasziba E, Flancbaum L, Fitzpatrick JC, Schneiderman J, Fisher H. Simultaneous determination of histidine-containing dipeptides, histamine, methylhistamine and histidine by high-performance liquid chromatography. J Chromatogr (1988) 432:315–20.
221. Flancbaum L, Fitzpatrick JC, Brotman DN, Marcoux AM, Kasziba E, Fisher H. The presence and significance of carnosine in histamine-containing tissues of several mammalian species. Agents Actions (1990) 31:190–6. doi:10.1007/BF01997607
222. Chez MG, Buchanan CP, Aimonovitch MC, Becker M, Schaefer K, Black C, et al. Double-blind, placebo-controlled study of L-carnosine supplementation in children with autistic spectrum disorders. J Child Neurol (2002) 17:833–7. doi:10.1177/08830738020170111501
223. Scherkl R, Hashem A, Frey HH. Histamine in brain – its role in regulation of seizure susceptibility. Epilepsy Res (1991) 10:111–8. doi:10.1016/0920-1211(91)90003-X
224. Kamei C, Ishizawa K, Kakinoki H, Fukunaga M. Histaminergic mechanisms in amygdaloid-kindled seizures in rats. Epilepsy Res (1998) 30:187–94. doi:10.1016/S0920-1211(98)00005-9
225. Zhang LS, Chen Z, Huang YW, Hu WW, Wei EQ, Yanai K. Effects of endogenous histamine on seizure development of pentylenetetrazole-induced kindling in rats. Pharmacology (2003) 69:27–32. doi:10.1159/000071263
226. Kamei C, Okuma C. Role of central histamine in amygdaloid kindled seizures. Nihon Yakurigaku Zasshi (2001) 117:329–34. doi:10.1254/fpj.117.329
227. Okuma C, Hirai T, Kamei C. Mechanism of the inhibitory effect of histamine on amygdaloid-kindled seizures in rats. Epilepsia (2001) 42:1494–500. doi:10.1046/j.1528-1157.2001.05601.x
228. Jin CL, Yang LX, Wu XH, Li Q, Ding MP, Fan YY, et al. Effects of carnosine on amygdaloid-kindled seizures in Sprague-Dawley rats. Neuroscience (2005) 135:939–47. doi:10.1016/j.neuroscience.2005.06.066
229. Wu XH, Ding MP, Zhu-Ge ZB, Zhu YY, Jin CL, Chen Z. Carnosine, a precursor of histidine, ameliorates pentylenetetrazole-induced kindled seizures in rat. Neurosci Lett (2006) 400:146–9. doi:10.1016/j.neulet.2006.02.031
230. Zhu YY, Zhu-Ge ZB, Wu DC, Wang S, Liu LY, Ohtsu H, et al. Carnosine inhibits pentylenetetrazol-induced seizures by histaminergic mechanisms in histidine decarboxylase knock-out mice. Neurosci Lett (2007) 416:211–6. doi:10.1016/j.neulet.2007.01.075
231. Kozan R, Sefil F, Bagirici F. Anticonvulsant effect of carnosine on penicillin-induced epileptiform activity in rats. Brain Res (2008) 1239:249–55. doi:10.1016/j.brainres.2008.08.019
232. Taha AY, Burnham WM, Auvin S. Polyunsaturated fatty acids and epilepsy. Epilepsia (2010) 51:1348–58. doi:10.1111/j.1528-1167.2010.02654.x
233. Terra VC, Arida RM, Rabello GM, Cavalheiro EA, Scorza FA. The utility of omega-3 fatty acids in epilepsy: more than just a farmed tilapia! Arq Neuropsiquiatr (2011) 69:118–21.
234. Yuen AW, Sander JW, Fluegel D, Patsalos PN, Bell GS, Johnson T, et al. Omega-3 fatty acid supplementation in patients with chronic epilepsy: a randomized trial. Epilepsy Behav (2005) 7:253–8. doi:10.1016/j.yebeh.2005.04.014
235. Yuen AW, Flugel D, Poepel A, Bell GS, Peacock JL, Sander JW. Non-randomized open trial of eicosapentaenoic acid (EPA), an omega-3 fatty acid, in ten people with chronic epilepsy. Epilepsy Behav (2012) 23:370–2. doi:10.1016/j.yebeh.2011.11.030
236. DeGiorgio CM, Miller P, Meymandi S, Gornbein JA. n-3 Fatty acids (fish oil) for epilepsy, cardiac risk factors, and risk of SUDEP: clues from a pilot, double-blind, exploratory study. Epilepsy Behav (2008) 13:681–4. doi:10.1016/j.yebeh.2008.08.001
237. Bromfield E, Dworetzky B, Hurwitz S, Eluri Z, Lane L, Replansky S, et al. A randomized trial of polyunsaturated fatty acids for refractory epilepsy. Epilepsy Behav (2008) 12:187–90. doi:10.1016/j.yebeh.2007.09.011
238. Puri BK, Koepp MJ, Holmes J, Hamilton G, Yuen AW. A 31-phosphorus neurospectroscopy study of omega-3 long-chain polyunsaturated fatty acid intervention with eicosapentaenoic acid and docosahexaenoic acid in patients with chronic refractory epilepsy. Prostaglandins Leukot Essent Fatty Acids (2007) 77:105–7. doi:10.1016/j.plefa.2007.07.004
239. Vancassel S, Durand G, Barthelemy C, Lejeune B, Martineau J, Guilloteau D, et al. Plasma fatty acid levels in autistic children. Prostaglandins Leukot Essent Fatty Acids (2001) 65:1–7. doi:10.1054/plef.2001.0281
240. Bell JG, MacKinlay EE, Dick JR, MacDonald DJ, Boyle RM, Glen AC. Essential fatty acids and phospholipase A2 in autistic spectrum disorders. Prostaglandins Leukot Essent Fatty Acids (2004) 71:201–4. doi:10.1016/j.plefa.2004.03.008
241. Wiest MM, German JB, Harvey DJ, Watkins SM, Hertz-Picciotto I. Plasma fatty acid profiles in autism: a case-control study. Prostaglandins Leukot Essent Fatty Acids (2009) 80:221–7. doi:10.1016/j.plefa.2009.01.007
242. Bell JG, Miller D, MacDonald DJ, MacKinlay EE, Dick JR, Cheseldine S, et al. The fatty acid compositions of erythrocyte and plasma polar lipids in children with autism, developmental delay or typically developing controls and the effect of fish oil intake. Br J Nutr (2010) 103:1160–7. doi:10.1017/S0007114509992881
243. Meguid NA, Atta HM, Gouda AS, Khalil RO. Role of polyunsaturated fatty acids in the management of Egyptian children with autism. Clin Biochem (2008) 41:1044–8. doi:10.1016/j.clinbiochem.2008.05.013
244. Meiri G, Bichovsky Y, Belmaker RH. Omega 3 fatty acid treatment in autism. J Child Adolesc Psychopharmacol (2009) 19:449–51. doi:10.1089/cap.2008.0123
245. Politi P, Cena H, Comelli M, Marrone G, Allegri C, Emanuele E, et al. Behavioral effects of omega-3 fatty acid supplementation in young adults with severe autism: an open label study. Arch Med Res (2008) 39:682–5. doi:10.1016/j.arcmed.2008.06.005
246. Johnson CR, Handen BL, Zimmer M, Sacco K. Polyunsaturated fatty acid supplementation in young children with autism. J Dev Phys Disabil (2010) 22:1–10. doi:10.1007/s10882-009-9152-x
247. Amminger GP, Berger GE, Schafer MR, Klier C, Friedrich MH, Feucht M. Omega-3 fatty acids supplementation in children with autism: a double-blind randomized, placebo-controlled pilot study. Biol Psychiatry (2007) 61:551–3. doi:10.1016/j.biopsych.2006.05.007
248. Bent S, Bertoglio K, Ashwood P, Bostrom A, Hendren RL. A pilot randomized controlled trial of omega-3 fatty acids for autism spectrum disorder. J Autism Dev Disord (2011) 41:545–54. doi:10.1007/s10803-010-1078-8
249. Rao ML, Roy R, Bell IR, Hoover R. The defining role of structure (including epitaxy) in the plausibility of homeopathy. Homeopathy (2007) 96:175–82. doi:10.1016/j.homp.2007.03.009
250. Wolf U, Wolf M, Heusser P, Thurneysen A, Baumgartner S. Homeopathic preparations of quartz, sulfur and copper sulfate assessed by UV spectroscopy. Evid Based Complement Alternat Med (2009) 2011:692798. doi:10.1093/ecam/nep036
251. Ernst E. Winnowing the chaff of charlatanism from the wheat of science. Evid Based Complement Alternat Med (2010) 7:425–6. doi:10.1093/ecam/nen089
252. Reilly D, Taylor M, Beattie N, Campbell J, McSharry C, Aitchison T, et al. Is evidence for homeopathy reproducible? Lancet (1994) 344(8937):1601–6. doi:10.1016/S0140-6736(94)90407-3
253. Linde K, Clausius N, Ramirez G, Melchart D, Eitel F, Hedges LV, et al. Are the clinical effects of homeopathy placebo effects? A meta-analysis of placebo-controlled trials. Lancet (1997) 350:834–43. doi:10.1016/S0140-6736(97)02293-9
254. Shang A, Huwiler-Muntener K, Nartey L, Juni P, Dorig P, Sterne J, et al. Are the clinical effects of homeopathy placebo effects? Comparative study of placebo-controlled trials of homeopathy and allopathy. Lancet (2005) 366:726–32. doi:10.1016/S0140-6736(05)67177-2
255. Frei H, Everts R, Ammon K, Kaufmann F, Walther D, Hsu-Schmitz S, et al. Homeopathic treatment of children with attention deficit hyperactivity disorder: a randomized, double blind, placebo controlled crossover trial. Eur J Pediatr (2005) 164:758–67. doi:10.1007/s00431-005-1735-7
258. Robinson TW. Homeopathic secretin in autism: a clinical pilot study. Br Homeopath J (2001) 90:86–91. doi:10.1054/homp.1999.0468
259. Whiteley P, Haracopos D, Knivsberg AM, Reichelt KL, Parlar S, Jacobsen J, et al. The ScanBrit randomised, controlled, singleblind study of a gluten- and casein-free dietary intervention for children with autism spectrum disorders. Nutr Neurosci (2010) 13:87–100. doi:10.1179/147683010X12611460763922
260. Elder JH, Shankar M, Shuster J, Theriaque D, Burns S, Sherrill L. The gluten-free, casein-free diet in autism: results of a preliminary double blind clinical trial. J Autism Dev Disord (2006) 36:413–20. doi:10.1007/s10803-006-0079-0
261. Pennesi CM, Klein LC. Effectiveness of the gluten-free, casein-free diet for children diagnosed with autism spectrum disorder: based on parental report. Nutr Neurosci (2012) 15:85–91.
262. Peltola M, Kaukinen K, Dastidar P, Haimila K, Partanen J, Haapala AM, et al. Hippocampal sclerosis in refractory temporal lobe epilepsy is associated with gluten sensitivity. J Neurol Neurosurg Psychiatry (2009) 80:626–30. doi:10.1136/jnnp.2008.148221
263. Haavik S, Altman K, Woelk C. Effects of the Feingold diet on seizures and hyperactivity: a single-subject analysis. J Behav Med (1979) 2:365–74. doi:10.1007/BF00844740
264. Sonuga-Barke EJ, Brandeis D, Cortese S, Daley D, Ferrin M, Holtmann M, et al. Nonpharmacological interventions for ADHD: systematic review and meta-analyses of randomized controlled trials of dietary and psychological treatments. Am J Psychiatry (2013) 170:275–89. doi:10.1176/appi.ajp.2012.12070991
265. Frye RE, Rotenberg A, Ousley M, Pascual-Leone A. Transcranial magnetic stimulation in child neurology: current and future directions. J Child Neurol (2008) 23:79–96. doi:10.1177/0883073807307972
266. Hoffman RE, Cavus I. Slow transcranial magnetic stimulation, long-term depotentiation, and brain hyperexcitability disorders. Am J Psychiatry (2002) 159:1093–102. doi:10.1176/appi.ajp.159.7.1093
267. Sokhadze EM, El-Baz A, Baruth J, Mathai G, Sears L, Casanova MF. Effects of low frequency repetitive transcranial magnetic stimulation (rTMS) on gamma frequency oscillations and event-related potentials during processing of illusory figures in autism. J Autism Dev Disord (2009) 39:619–34. doi:10.1007/s10803-008-0662-7
268. Sokhadze E, Baruth J, Tasman A, Mansoor M, Ramaswamy R, Sears L, et al. Low-frequency repetitive transcranial magnetic stimulation (rTMS) affects event-related potential measures of novelty processing in autism. Appl Psychophysiol Biofeedback (2010) 35:147–61. doi:10.1007/s10484-009-9121-2
269. Casanova MF, Buxhoeveden DP, Switala AE, Roy E. Minicolumnar pathology in autism. Neurology (2002) 58:428–32. doi:10.1212/WNL.58.3.428
270. Casanova MF, van Kooten IA, Switala AE, van Engeland H, Heinsen H, Steinbusch HW, et al. Minicolumnar abnormalities in autism. Acta Neuropathol (2006) 112:287–303. doi:10.1007/s00401-006-0085-5
271. Sokhadze EM, Baruth JM, Sears L, Sokhadze GE, El-Baz AS, Casanova MF. Prefrontal neuromodulation using rTMS improves error monitoring and correction function in autism. Appl Psychophysiol Biofeedback (2012) 37:91–102. doi:10.1007/s10484-012-9182-5
272. Fregni F, Otachi PT, Do Valle A, Boggio PS, Thut G, Rigonatti SP, et al. A randomized clinical trial of repetitive transcranial magnetic stimulation in patients with refractory epilepsy. Ann Neurol (2006) 60:447–55. doi:10.1002/ana.20950
273. Theodore WH, Hunter K, Chen R, Vega-Bermudez F, Boroojerdi B, Reeves-Tyer P, et al. Transcranial magnetic stimulation for the treatment of seizures: a controlled study. Neurology (2002) 59:560–2. doi:10.1212/WNL.59.4.560
274. Cantello R, Rossi S, Varrasi C, Ulivelli M, Civardi C, Bartalini S, et al. Slow repetitive TMS for drug-resistant epilepsy: clinical and EEG findings of a placebo-controlled trial. Epilepsia (2007) 48:366–74. doi:10.1111/j.1528-1167.2006.00938.x
275. Kimiskidis VK, Kugiumtzis D, Papagiannopoulos S, Vlaikidis N. Transcranial magnetic stimulation (TMS) modulates epileptiform discharges in patients with frontal lobe epilepsy: a preliminary EEG-TMS study. Int J Neural Syst (2013) 23:1250035. doi:10.1142/S0129065712500359
276. 罗西尼奥尔,弗莱 RE自闭症谱系障碍生理异常研究趋势综述:免疫失调、炎症、氧化应激、线粒体功能障碍及环境毒性暴露。《分子精神病学》(2012)17:389–401。DOI:10.1038/MP.2011.165
278. 卡根-库什尼尔 T,罗伯茨 SW,斯尼德 OC III。自闭症谱系障碍中脑电图筛查:循证指南。《儿童神经学杂志》(2005)20:197–206。
279. Depositario-Cabacar DF,Zelleke TG。发育障碍儿童癫痫的治疗。Dev Disabil Res Rev(2010)16:239–47。doi:10.1002/ddrr.116
280。关P,布罗迪,MJ。癫痫和抗癫痫药物的神经心理效应。柳叶刀(2001年)357:216–22。doi:10.1016/S0140-6736(00)03600-X
281. 查德曼KK,瓜里利亚SR,尤JH。动物模型研究带来自闭症谱系障碍治疗的新方向。专家观点药物分析(2012)7:407–416。doi:10.1517/17460441.2012.678828
282. 科格兰·S,霍德·J,英克斯特·B,门德斯·马萨诸塞,墨菲,DJ·纳特。自闭症及相关疾病中的GABA系统功能障碍:从突触到症状。《神经科学生物行为评论》(2012)36:2044–55。doi:10.1016/j.neubiorev.2012.07.005
283. 卡兰德雷 EP,多明格斯-格拉纳多斯 R,戈麦斯-鲁比奥 M,莫利纳-方特 JA。苯巴比妥和丙戊酸长期治疗对学童的认知影响。《神经学研究》(Acta Neurol Sscand)(1990)81:504–506。doi:10.1111/j.1600-0404.1990.tb01008.x
284. De Vivo DC、Bohan TP、Coulter DL、Dreifuss FE、Greenwood RS、Nordli DR Jr等。L-肉碱补充剂在儿童癫痫中的现状视角。癫痫(1998)39:1216–25。doi:10.1111/J.1528-1157.1998.TB01315.x
285. Lheureux PE,Hantson P. 肉碱在治疗丙戊酸诱导毒性中的应用。Clin Toxicol(费城)(2009年)47:101–11。doi:10.1080/15563650902752376
286. 弗莱 RE,罗西尼奥尔 DA。线粒体功能障碍可以将自闭症谱系障碍相关的多种医学症状联系起来。《儿科研究》(2011)69:41R–7。doi:10.1203/PDR.0b013e318212f16b
287。考尔特DL。肉碱缺乏:丙戊酸肝毒性的可能机制。《柳叶刀》(1984年)1:689。doi:10.1016/S0140-6736(84)92209-8
288. Coulter DL。肉碱、丙戊酸盐和毒性。《儿童神经学杂志》(1991年)6:7–14。DOI:10.1177/088307389100600102
289. Major P, Greenberg E, Khan A, Thiele EA. 吡哆醇补充剂用于治疗儿童左旋拉西坦诱导行为副作用:初步结果。癫痫行为(2008)13:557–9。doi:10.1016/j.yebeh.2008.07.004
290. Davis GP, McCarthy JT, Magill DB, Coffey B. Behavioral effects of levetiracetam mitigated by pyridoxine. J Child Adolesc Psychopharmacol (2009) 19:209–11. doi:10.1089/cap.2009.19202
291. Finsterer J, Zarrouk Mahjoub S. Mitochondrial toxicity of antiepileptic drugs and their tolerability in mitochondrial disorders. Expert Opin Drug Metab Toxicol (2012) 8:71–9. doi:10.1517/17425255.2012.644535
292. Berger I, Segal I, Shmueli D, Saada A. The effect of antiepileptic drugs on mitochondrial activity: a pilot study. J Child Neurol (2010) 25:541–5. doi:10.1177/0883073809352888
293. Kim YJ, Ko HH, Han ES, Lee CS. Lamotrigine inhibition of rotenone- or 1-methyl-4-phenylpyridinium-induced mitochondrial damage and cell death. Brain Res Bull (2007) 71:633–40. doi:10.1016/j.brainresbull.2006.12.006
294. Kossoff EH, Zupec-Kania BA, Rho JM. Ketogenic diets: an update for child neurologists. J Child Neurol (2009) 24:979–88. doi:10.1177/0883073809337162
295. Mantis JG, Fritz CL, Marsh J, Heinrichs SC, Seyfried TN. Improvement in motor and exploratory behavior in Rett syndrome mice with restricted ketogenic and standard diets. Epilepsy Behav (2009) 15:133–41. doi:10.1016/j.yebeh.2009.02.038
296. Masino SA, Kawamura M, Wasser CD, Pomeroy LT, Ruskin DN. Adenosine, ketogenic diet and epilepsy: the emerging therapeutic relationship between metabolism and brain activity. Curr Neuropharmacol (2009) 7:257–68. doi:10.2174/157015909789152164
297. 约兹维亚克 S, 科索夫 EH, 科图尔斯卡-约兹维亚克 K. 癫痫的饮食治疗:古老疗法的复兴。《神经神经病学》(2011)45:370–8。
298. 鲍 KJ、韦瑟灵顿 J、哈塞尔 B、帕雷 JF、加维鲁克 JW、格林 JG 等。线粒体生物合成在生酮饮食抗癫痫机制中的应用。Ann Neurol (2006) 60:223–235。DOI:10.1002/ana.20899
299. Bough K. 作为生酮饮食抗癫痫机制的一部分能量代谢。癫痫(2008)49(Suppl 8):91–3。doi:10.1111/j.1528-1167.2008.01846.x
300。霍瓦斯·R,戈尔曼·G,奇纳里大前锋。我们如何治疗线粒体脑肌病?治疗方法。神经治疗学(2008年)5:558–568。doi:10.1016/j.nurt.2008.07.002
301. Finsterer J. 线粒体疾病的治疗。《欧洲儿科神经学杂志》(2010)14:29–44。doi:10.1016/j.ejpn.2009.07.005
302. Pickett J, Xiu E, Tuchman R, Dawson G, Lajonchere C. 自闭症患者(有癫痫和无癫痫)的死亡率。《儿童神经学杂志》(2011)26:932–939。doi:10.1177/0883073811402203
关键词:抗癫痫药物、自闭症谱系障碍、癫痫、无麸质酪蛋白饮食、生酮饮食、癫痫发作、治疗 引文:Frye RE、Rossignol D、Casanova MF、Brown GL、Martin V、Edelson S、Coben R、Lewine J、Slattery JC、Lau C、Hardy P、Fatemi SH、Folsom TD、MacFabe D 和 Adams JB(2013)自闭症谱系障碍中传统与新颖癫痫治疗方法综述:系统综述与专家小组研究结果。前面。公共卫生 1:31。DOI: 10.3389/fpubh.2013.00031 接收日期:2013年4月21日;待发表论文:2013年5月29日;
录用日期:2013年8月20日;在线发布日期:2013年9月13日。 编辑: 伊尔克努尔·艾丁·阿夫齐土耳其Ondokuz Mayis大学
审阅者: 萨廷德尔·阿涅贾印度哈丁奇夫人医学院
克拉拉·范·卡尔内贝克加拿大不列颠哥伦比亚大学
版权所有:© 2013 弗莱、罗西尼奥尔、卡萨诺瓦、布朗、马丁、埃德尔森、科本、莱温、斯莱特里、劳、哈代、法特米、福尔瑟姆、麦克费布和亚当斯。这是一篇开放获取的文章,根据以下条款发布,知识共享署名许可(CC BY).允许在其他论坛使用、分发或复制,前提是原作者或许可方注明署名,并且引用本期刊的原始发表,符合公认的学术惯例。不允许不符合这些条款的使用、分发或复制。 *通信:理查德·E·弗莱,阿肯色儿童医院研究所,地址:13 Children's Way,阿肯色州小石城,地址:72202,美国电子邮件:refrye@uams.edu
免責聲明: 本文中表达的所有主张仅代表作者本人,不一定代表其关联组织或出版商、编辑和审稿人的立场。本文中可能评估的任何产品或制造商可能提出的声明,均不由出版商保证或背书。
|